Immature Platelet Fraction: Allrounder unter den Biomarkern
DOI: https://doi.org/10.47184/td.2024.04.01Unreife Thrombozyten dienen als Biomarker für die Diagnose und Prognose zahlreicher Erkrankungen. Sie sind besonders nützlich bei der Differenzialdiagnose von Thrombozytopenien, bei der Beurteilung der Thrombopoese nach Transplantation oder Chemotherapie, bei Infektionen und als Marker für unerwünschte kardiovaskuläre Ereignisse.
Schlüsselwörter: Durchflusszytometrie, unreife Thrombozytenfraktion
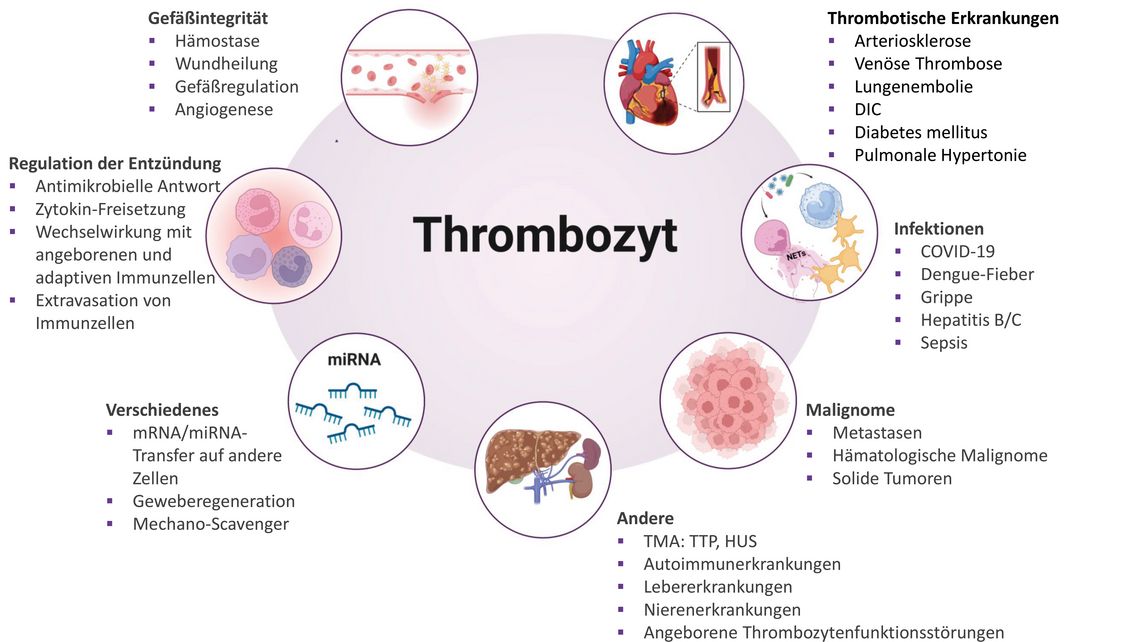
Thrombozyten, die traditionell als zentrale Akteure der Hämostase und Thrombose angesehen werden, haben eine Vielzahl weiterer physiologischer und pathologischer Funktionen (Abb. 1).
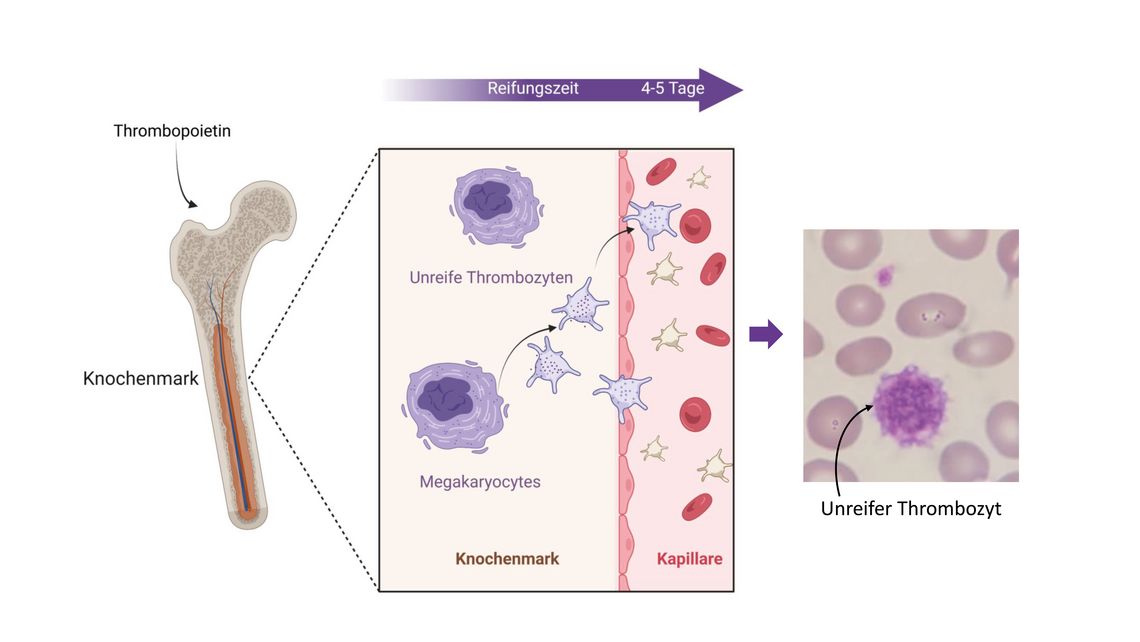
Zu ihren physiologischen Aufgaben gehören die Aufrechterhaltung der Gefäßintegrität, die Förderung der Wundheilung und der Angiogenese sowie die Regulation der Plasma-Homöostase. Nach mechanischer Belastung oder Endothelschädigung initiieren und fördern sie die Thrombosebildung. Aber auch bei Entzündungsprozessen spielen sie eine zentrale Rolle, indem sie mit Immunzellen interagieren und Zytokine freisetzen. Ihre pathologische Bedeutung zeigt sich daher nicht nur bei thrombotischen Erkrankungen, sondern auch im Rahmen von Infektionen (z. B. Sepsis und Virusinfektionen) sowie bei malignen, entzündlichen und Autoimmunerkrankungen [1]. Diese funktionelle Vielseitigkeit ist bemerkenswert, insbesondere wenn man bedenkt, dass es sich um kleine, kernlose Zellen (2 bis 4 µm) mit einer Lebensdauer von nur acht bis zehn Tagen handelt. Die Thrombozytenkonzentration im Blut eines gesunden Menschen liegt zwischen 150 und 450 × 10⁹/l. Um diesen Wert aufrechtzuerhalten, werden täglich etwa 10¹¹ Thrombozyten durch Abschnürung von Megakaryozyten im Knochenmark gebildet. Unreife oder sogenannte retikulierte Thrombozyten (RP) sind junge Thrombozyten, die erst kürzlich in den Blutkreislauf gelangt sind (Abb. 2).
Sie sind größer und enthalten RNA, wobei die RNA-Menge und die Zellgröße im Laufe von 24 bis 36 Stunden allmählich abnehmen [2]. Der RNA-Gehalt der Thrombozyten korreliert direkt mit der Aktivität der Megakaryozyten und dient somit als Indikator für die Knochenmarkaktivität. Retikulierte Thrombozyten können daher als Marker für den Thrombozytenumsatz und die Thrombopoese verwendet werden [3]. Diese unreifen Zellen weisen eine erhöhte Granulatdichte auf, synthetisieren vermehrt prothrombotische Faktoren wie Thromboxan A2 und zeigen eine verstärkte Expression von Oberflächenaktivierungsmarkern wie dem GPIIbIIIa- oder dem GPI-Rezeptor. Diese Eigenschaften machen sie funktionell reaktiver und fördern die Thrombozytenaktivierung und -aggregation. Eine Transkriptomanalyse ergab eine signifikante Anreicherung prothrombotischer Gene in retikulierten Thrombozyten. Dies erklärt ihren proaggregatorischen Phänotyp und weist auf einen möglichen kausalen Zusammenhang mit ungünstigen kardiovaskulären Folgen hin [4].
Labordiagnostik der unreifen Thrombozyten
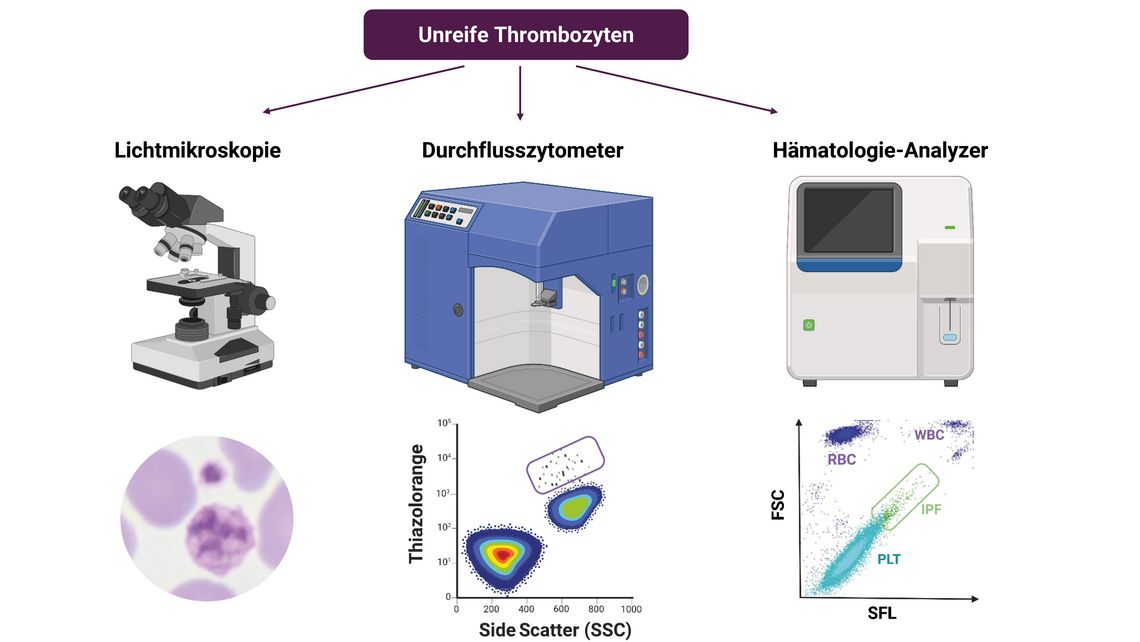
Für die Messung unreifer Thrombozyten stehen verschiedene labordiagnostische Methoden zur Verfügung (Abb. 3).
1969 entdeckten Ingram und Coopersmith im Hundemodell, dass nach akutem Blutverlust neu freigesetzte Thrombozyten grobe RNA-Reste enthalten, die supravital mit Methylenblau angefärbt und mikroskopisch gezählt werden können [5]. Diese Entdeckung war ein erster wichtiger Schritt in der Analyse unreifer Thrombozyten. Ein weiterer wichtiger Fortschritt wurde 1990 erzielt, als Kienast und Schmitz die Durchflusszytometrie mit Thiazolorange (TO) zur RNA-Färbung einführten [6]. Die Ergebnisse dieser Methode werden als prozentualer Anteil der retikulierten Thrombozyten (RP) an der Gesamtzahl der Thrombozyten (%RP) angegeben. Im Laufe der Zeit wurde die Methode weiter verfeinert, indem sie mit thrombozytenspezifischen monoklonalen Antikörpern wie Anti-GPIb- (CD42b) oder Anti-GPIIbIIIa (CD41 bzw. CD61) kombiniert wurde, was eine noch genauere Zählung der Thrombozyten ermöglichte [7]. Die Durchflusszytometrie mit Thiazolorange zeigte jedoch tendenziell höhere RP-Werte, was wahrscheinlich auf die unspezifische Bindung von TO an Delta-Granula und DNA zurückzuführen ist. Der klinische Nutzen dieser Technik blieb jedoch aufgrund der fehlenden Standardisierung und der variablen Referenzintervalle begrenzt [8].
Eine alternative Methode zur Bestimmung der unreifen Thrombozytenfraktion (Immature Platelet Fraction; IPF) ist der Einsatz von automatisierten Hämatologie-Analysegeräten. Auch hier erfolgt die IPF-Messung durch Fluoreszenzfarbstoffe, die die RNA in den unreifen Thrombozyten markieren, sowie durch Streulicht- und Fluoreszenzanalyse [3, 8]. Die Ergebnisse werden sowohl in Prozent (%IPF) als auch in absoluten Zahlen (#IPF) angegeben. Unterschiede in den Ergebnissen sind hauptsächlich auf die verwendeten Farbstoffe, Streulichtkonfigurationen und Datenverarbeitungsalgorithmen zurückzuführen. Die IPF ist eine zuverlässige Messgröße, die in der Routinediagnostik zur Verfügung steht. Sie bleibt bei Raumtemperatur in EDTA-antikoagulierten Proben bis zu 24 Stunden und in Citrat-antikoagulierten Proben bis zu sechs Stunden stabil [9]. Trotz der klinischen Verfügbarkeit besteht noch Verbesserungsbedarf bei der Standardisierung sowie der internen und externen Qualitätskontrolle. Auch die Vergleichbarkeit der Messergebnisse zwischen verschiedenen Analysegeräten muss noch optimiert werden.
Klinischer Nutzen
Hämatologische Erkrankungen
Die Ursachen der Thrombozytopenie sind vielfältig, und die Differenzialdiagnose kann eine Herausforderung darstellen. Eine zentrale Frage bei der Abklärung ist, ob die Thrombozytopenie auf eine Knochenmarkinsuffizienz, eine erhöhte periphere Zerstörung oder einen erhöhten Verbrauch zurückzuführen ist. Eine der wichtigsten und am häufigsten untersuchten Anwendungen der retikulierten Thrombozyten (RP) und der unreifen Thrombozytenfraktion (IPF) ist die Differenzialdiagnose von Thrombozytopenien [10–17].
Bei Erkrankungen mit peripherer Zerstörung oder Verbrauch wie Immunthrombozytopenie (ITP), thrombotische thrombozytopenische Purpura (TTP) und disseminierte intravasale Gerinnung (DIC) ist die IPF häufig erhöht. Im Gegensatz dazu bleibt die IPF bei Knochenmarkversagen wie der aplastischen Anämie (AA) oder dem myelodysplastischen Syndrom (MDS) im Referenzbereich. Interessanterweise weisen erhöhte IPF-Werte bei MDS-Patient:innen trotz normaler Thrombozytenzahl auf eine prognostisch ungünstige Chromosomenanomalie hin [18]. Die IPF liefert daher wertvolle Informationen über die Thrombopoese und kann in vielen Fällen helfen, eine invasive Knochenmarkbiopsie zu vermeiden.
Mehrere Studien haben einen Anstieg der IPF bei Patient:innen mit ITP in Remission gezeigt, wobei der Medianwert der IPF zwischen 5,7 und 22,3 % lag. Eine Studie von Abe et al. berichtete über eine Sensitivität von 86,8 % und eine Spezifität von 92,6 % bei einem Cut-off-Wert von 7,7 % [19]. Erhöhte IPF-Werte wurden auch bei mikroangiopathischen Syndromen wie der thrombotischen thrombozytopenischen Purpura gefunden. Beispielsweise lag in einer Studie von Briggs et al. der durchschnittliche IPF-Wert bei 17,2 % (in einem Bereich von 11,2 bis 30,9 %), der sich aber während der Remission normalisierte [20, 21]. Die Messung der IPF kann daher nicht nur für die Diagnose, sondern auch für die Überwachung und Therapieanpassung bei TTP hilfreich sein.
RP und IPF haben sich auch als zuverlässige Prognoseinstrumente für die Wiederherstellung der Thrombozytenproduktion nach Knochenmark- oder Stammzelltransplantation erwiesen. Bei diesen Patient:innen wurde ein Anstieg der RP mehrere Tage vor einem Anstieg der Gesamtplättchenzahl beobachtet. Es konnte gezeigt werden, dass eine erhöhte RP/IPF einer der frühesten Prädiktoren für eine hämatopoetische Erholung ist. Bei peripherer Stammzelltransplantation (PBSC) oder allogener Knochenmarktransplantation geht der Anstieg der IPF einem Anstieg der Gesamtthrombozytenzahl um durchschnittlich 2 bis 5 Tage voraus. Bei der autologen Stammzelltransplantation erwies sich ein Cut-off-Wert von 5,3 % in der IPF als prädiktiv für eine Thrombozytenerholung innerhalb von zwei Tagen.
Es wurde sogar postuliert, dass die Implementierung der IPF in Transfusionsstrategien, die derzeit hauptsächlich auf der Thrombozytenzahl basieren, die Anzahl der erforderlichen Thrombozytentransfusionen in der thrombozytopenischen Phase nach Chemotherapie reduzieren könnte.
Herz-Kreislauf-Erkrankungen
Mehrere Studien haben einen Zusammenhang zwischen erhöhten IPF-Werten und kardiovaskulären Erkrankungen wie kardioembolischem Schlaganfall, Diabetes mellitus, koronarer Herzkrankheit (KHK) und insbesondere akutem Koronarsyndrom (ACS) gezeigt. Diese Ergebnisse unterstreichen die Bedeutung von IPF und RP als diagnostische und prognostische Marker für unerwünschte kardiovaskuläre Ereignisse. Bei Menschen mit ST-Hebungsinfarkt (STEMI) waren die RP-Werte bis zu viermal höher als bei Kontrollpersonen. Außerdem waren die Werte bei STEMI signifikant stärker erhöht als bei anderen Formen des ACS. Eine Metaanalyse mit 2.213 Patient:innen zeigte, dass erhöhte RP-Werte mit einem signifikant höheren Risiko für kardiovaskuläre Ereignisse und kardiovaskulären Tod assoziiert waren [4]. Zwei systematische Analysen bestätigten, dass erhöhte RP-Werte sowohl bei akuter als auch bei stabiler ischämischer Herzkrankheit mit schwerwiegenden kardiovaskulären Ereignissen in der Kurz- und Langzeitbeobachtung korrelieren [22, 23]. Im Gegensatz dazu konnten Pedersen et al. in einer Studie an 900 Patient:innen mit stabiler koronarer Herzkrankheit (KHK) keinen prognostischen Wert der RP-Werte für zukünftige kardiovaskuläre Ereignisse während einer Nachbeobachtungszeit von drei Jahren nachweisen [24].
Das Verhalten von RP unter der Wirkung von Thrombozytenaggregationshemmern ist von großem klinischen Interesse, da RP aufgrund ihrer prothrombotischen Eigenschaften eine erhöhte Reaktivität aufweisen. Mehrere Studien haben gezeigt, dass hohe IPF-Werte mit einer verminderten Wirksamkeit von Thrombozytenaggregationshemmern wie P2Y12-Inhibitoren (z. B. Clopidogrel) und Aspirin assoziiert sind [25–29]. Ähnliche Ergebnisse wurden bei Patient:innen unter Prasugrel-Therapie beobachtet [30, 31]. Ein erhöhter IPF-Wert zu Beginn der Therapie könnte ein relevanter Faktor für die eingeschränkte Wirksamkeit der dualen Thrombozytenaggregationshemmung und das damit verbundene Risiko für nachfolgende kardiovaskuläre Ereignisse sein [32].
Infektionen und Sepsis
Unreife Thrombozyten können als potenzielle Biomarker für die Frühdiagnose, die Überwachung des Krankheitsverlaufs und die Prognoseabschätzung bei systemischen Infektionen und Sepsis dienen. Erhöhte IPF-Werte zeigen eine starke Korrelation mit dem SOFA-Score sowie eine hohe Sensitivität und Spezifität für die Früherkennung und Unterscheidung von Sepsis [33–36]. Die Studie von Jones et al. zeigte, dass IPF neben Procalcitonin als besonders geeignet für die sensitive und spezifische Identifizierung von Bakteriämien auf der Intensivstation angesehen werden kann [37]. Systematische Übersichtsarbeiten zeigten, dass hohe IPF-Werte mit erhöhter Mortalität und schwereren Krankheitsverläufen bei Sepsis assoziiert sind [20, 21]. Mehrere Arbeiten weisen darauf hin, dass eine erhöhte Anzahl zirkulierender unreifer Thrombozyten mit einer erhöhten Mortalität und einem schwereren Krankheitsverlauf bei Sepsis und septischem Schock assoziiert ist. Eine Abnahme der IPF-Werte an den Tagen 3 und 5 nach Krankenhausaufnahme ist jedoch ein unabhängiger Prädiktor für eine schwere Thrombozytopenie und die 28-Tage-Mortalität. Die thrombopoetische Dysfunktion spiegelt somit den Schweregrad der Sepsis wider [38]. IPF hat sich auch als wertvoller Frühmarker für die Erholung der Thrombozytenzahl und zur Überwachung des Schweregrads bei viralen Infektionen wie Dengue-Fieber oder Covid-19 erwiesen [39, 40].
Fazit
Unreife Thrombozyten werden in der klinischen Praxis als diagnostische und prognostische Biomarker neben den oben ausführlich dargestellten Indikationen mit einer Vielzahl klinischer Anwendungen in Verbindung gebracht (Tab. 1).
Tab. 1: Mögliche klinische Anwendungen von unreifen Thrombozyten (mod. nach [2, 8]).
Klinische Anwendungsmöglichkeiten |
|---|
Differenzialdiagnose der Thrombozytopenie |
Vorhersage des Ansprechens auf thrombopoetische Arzneimittel |
Beurteilung der Krankheitsaktivität und Anpassung der Therapie bei ITP und TTP |
Vorhersage der nächsten Thrombozytopenie-Phase bei zyklischer Thrombozytopenie |
Klinische Beurteilung der myelodysplastischen Syndrome, Prognoseabschätzung |
Thrombopoesegenesung nach Knochenmark-/Stammzelltransplantation oder Chemotherapie |
Differenzialdiagnose schwangerschaftsassoziierter Thrombozytopenien |
Überwachung der Präeklampsie |
Abschätzung des thrombotischen Risikos bei Thrombozytose |
Früherkennung von Infektionen |
Vorhersage einer Sepsis bei kritisch kranken Patient:innen |
Risikoabschätzung bei Patient:innen mit kardiovaskulären Erkrankungen |
Vorhersage des Ansprechens auf eine Therapie mit Thrombozytenaggregationshemmer |
Risikoabschätzung für kardiovaskuläre Ereignisse und kardiovaskulären Tod nach ACS |
Unterstützung bei der Indikationsstellung für prophylaktische Thrombozytentransfusion |
Differenzierung zwischen Hepatitis und Zirrhose |
Vorhersage kardiovaskulärer Komplikationen bei Diabetes mellitus |
Beurteilung des Einflusses der Hämodialyse auf die Thrombozytenkinetik |
Vorhersage kardiovaskulärer Komplikationen nach Nierentransplantation |
Vorhersage des Schweregrads der Thrombozytopenie bei Neugeborenen |
Besonders nützlich sind sie bei der Differenzialdiagnose und der Überwachung von Thrombozytopenien, bei der Beurteilung der Thrombopoese nach Transplantation oder Chemotherapie sowie bei Infektionen. Ihre Rolle als Biomarker für die Prognose kardiovaskulärer Ereignisse und für das Monitoring des Ansprechens auf Thrombozytenaggregationshemmer ist vielversprechend und gut belegt.
Der Einsatz von IPF als Biomarker in der klinischen Routine ist jedoch mit einigen Einschränkungen verbunden. Ein zentraler Aspekt ist das Fehlen spezifischer und etablierter Cut-off-Werte, die für verschiedene Krankheitsbilder und klinische Szenarien geeignet sind. Darüber hinaus besteht eine Variabilität zwischen Studien, die auf unterschiedliche Analysegeräte, Messmethoden und uneinheitliche Cut-off-Definitionen zurückzuführen ist. Diese Heterogenität erschwert sowohl die Vergleichbarkeit der Ergebnisse als auch deren Umsetzung in die klinische Praxis.
Zukünftige standardisierte Studien sollten darauf abzielen, die Reproduzierbarkeit und Vergleichbarkeit der Messmethoden zu verbessern, klare Grenzwerte zu definieren und die Integration der IPF in die klinische Routine zu unterstützen. Kliniker:innen steht dann ein schneller, kostengünstiger und wertvoller Biomarker als Allrounder für Diagnostik, Prognose und personalisierte Therapie zur Verfügung.