Transplantationsmedizin - Quo vadis?
DOI: https://doi.org/10.47184/td.2024.02.01Lange Zeit war man sich uneinig, welche Zellen des Immunsystems für Transplantatabstoßungen verantwortlich sind. Mittlerweile herrscht Konsens, dass sowohl B-Lymphozyten und die von ihnen produzierten Antikörper als auch T-Lymphozyten sowie Zellen des angeborenen Immunsystems an Abstoßungsreaktionen beteiligt sind. Hieraus ergeben sich Implikationen für die Therapie und die Diagnostik.
Schlüsselwörter: C4d, DSA, MMDx, B-Hot, KI, Liquid Biopsy, Xenotransplantation
Bevor man Prognosen wagt, wohin die Reise der Transplantationsmedizin gehen könnte, lohnt ein kurzer Blick zurück auf große Errungenschaften und hartnäckig verfolgte Irrwege.
Wechsel der Paradigmen
Der Wissenschaftstheoretiker Thomas S. Kuhn hat wissenschaftlichen Fortschritt als diskontinuierlichen Prozess und Abfolge von konkurrierenden Denkmodellen (Paradigmen) beschrieben [1]. Das war auch in der Transplantationsmedizin der Fall. Kaum hatten die beiden Säulen der erworbenen Immunität – die zelluläre (T-Lymphozyten) und die humorale (Antikörper und Komplement) – in der ersten Hälfte des 20. Jahrhunderts Kontur angenommen, teilte sich die Transplantationsmedizin auf in ein zelluläres und ein humorales Lager. Es begann ein jahrelanges, zähes Ringen um die Deutungshoheit [2]. Auch Elemente der angeborenen Immunität (Makrophagen und natürliche Antikörper) wurden erkannt, spielten aber vorerst keine Rolle.
Zunächst schien das humorale Lager die Oberhand zu gewinnen. Karl Landsteiner (Nobelpreis 1930) entdeckte die Blutgruppen (AB0) und deren Bedeutung, und Paul Terasaki konnte in den 1960er-Jahren das gefürchtete Phänomen der hyperakuten Abstoßung aufklären (präformierte, Donor-spezifische Alloantikörper [DSA] im Empfänger, erworben durch frühere Transplantate, Bluttransfusionen oder Schwangerschaften) und dann mittels eines Crossmatch-Tests (In-vitro-Reaktion von Empfängerserum mit Spenderlymphozyten) verhindern. Damit waren die größten „humoralen“ Gefahren gebannt, und der Weg war frei für das zelluläre Paradigma.
Sir Peter Medawar (Medizinnobelpreis 1960) hatte auf der Grundlage vieler experimenteller Hauttransplantationen in den 1940er-/1950er-Jahren schließlich verfügt, dass Organabstoßungen hauptsächlich durch Lymphozyten verursacht würden. Dieses Diktum wurde bereitwillig angenommen und auf die gesamte Transplantationsmedizin übertragen – mit weitreichenden Konsequenzen in mehreren Bereichen. So wurden weitere Untersuchungen zur Bildung und Wirkung von Alloantikörpern nach einer Transplantation nur sporadisch durchgeführt bzw. blieben ganz auf der Strecke. Histopathologische Untersuchungen von Transplantatbiopsien konzentrierten sich auf das Verteilungsmuster von infiltrierenden Lymphozyten im jeweiligen Organ. Die kapillären Netzwerke (ausgenommen die prominenten glomerulären Kapillarschlingen) im Interstitium blieben weitgehend unbeachtet. Es wurden Immunsuppressiva entwickelt und in der Klinik erprobt, die hauptsächlich die zelluläre Immunität bändigen konnten (z. B. Calcineurin-Inhibitoren). Ihr therapeutischer Erfolg stärkte wiederum das zelluläre Paradigma.
Heute wissen wir, dass die Generalisierung des zellulären Dogmas ein Fehlschluss war. Bei der Vaskularisierung von Hauttransplantaten werden die Kapillaren des Spenders von denen des Empfängers verdrängt. Antikörper und andere Entzündungsmoleküle des Empfängers verbleiben im eigenen endothelialen Raum und treffen gar nicht auf das fremde Endothel, und es findet keine humorale Abstoßung statt. In anderen Organen (z. B. Niere und Herz) können sie jedoch direkt auf das fremde Endothel treffen und eine solche auslösen.
Die Renaissance der humoralen Immunität in der Transplantationsmedizin setzte daher mit Verzögerung ein. In den frühen 1990er-Jahren hatte Philip Halloran bemerkt, dass Abstoßungsreaktionen in Nieren in der Gegenwart von zirkulierenden Alloantikörpern ein besonderes histologisches Muster aufweisen (Akkumulation von Leukozyten in den Kapillaren; „microvascular inflammation“). Er scheiterte jedoch längere Zeit am Widerstand der Pathologie, diese Abstoßungsform als eigene Entität in die Banff-Klassifikation aufzunehmen. Erst nachdem Jahre später die kapilläre C4d-Färbung als Beleg für eine humorale Anti-Endothel-Reaktion allgemein anerkannt worden war [3], konnte das Konzept der humoralen Abstoßung Gestalt annehmen. Endgültig bestätigt wurde es Anfang der 2000er-Jahre durch gezielte therapeutische Interventionsstudien (z. B. selektive Antikörperelimination mittels Immunadsorption) – zuerst durch Georg Böhmig.
Ist die Dichotomie von T- und B-Zelle noch zeitgemäß?
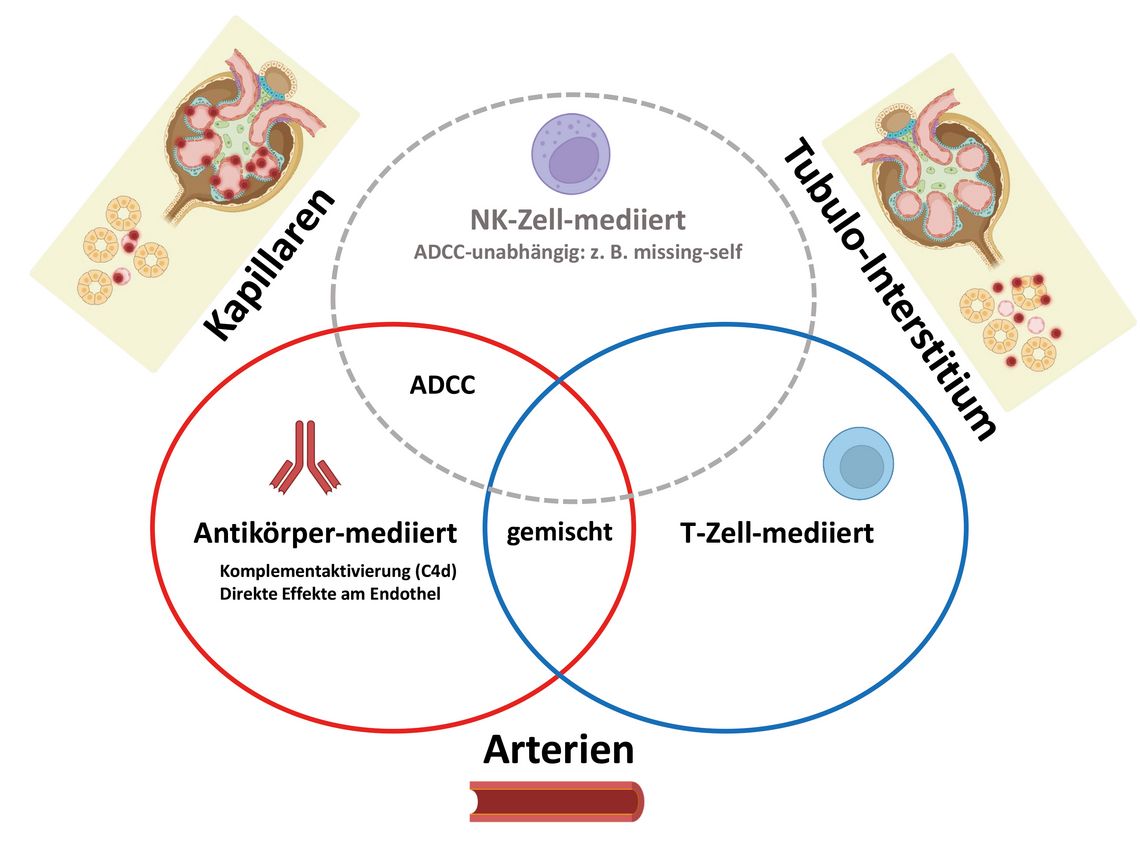
Die folgende Dichotomie bot sich damit als Konsens an: Zelluläre Abstoßungen (hauptsächlich von T-Zellen verursacht) betreffen vornehmlich das Interstitium (und manchmal auch Arterien), humorale Abstoßungen (nach Aktivierung von B-Zellen) bewirken durch Alloantikörper eine Entzündungsreaktion hauptsächlich in der Mikrozirkulation – Mischformen sind möglich. Mit dieser Einteilung konnten sich viele Transplantationsmediziner:innen alsbald anfreunden. Neue molekularbiologische Methoden forderten den gewonnenen Konsens jedoch sogleich wieder heraus bzw. stellten diese Dichotomie infrage [4].
Seit einigen Jahren ist es möglich, auf der Basis von Microarrays unterschiedliche Muster der Genexpression in Transplantatbiopsien (aus Niere, Herz und Lunge) zu erkennen. Federführend in dieser neuen Technologie wiederum war die Gruppe von Philip Halloran in Edmonton, CAN, die in Kollaboration mit anderen Zentren das Molecular Microscope Diagnostic System (MMDx) entwickelt hat [5]. Erklärtes Ziel ist, zusätzlich zur Morphologie mehr Informationen zur Art und Intensität von Entzündungsprozessen auf molekularer Ebene zu erhalten. So konnten bereits einige „Archetypen“ der Entzündungsreaktion definiert werden. In der Tat scheinen molekulare Parameter besser in der Vorhersage des Transplantatüberlebens (Niere) zu sein als histologische Parameter. Andere Testsysteme (z. B. das Banff Human Organ Transplant Gene Panel [B-HOT] oder Single-cell RNA Sequencing) verfolgen ähnliche Ziele.
Ein erstes, „prominentes“ Opfer dieses Ansatzes war die erst kürzlich akzeptierte Entität der antikörpervermittelten humoralen Abstoßung mit Nachweis von Donor-spezifischen Antikörpern in der Zirkulation und von kapillärem C4d in der Biopsie (DSA+/C4d+). Es stellte sich heraus, dass ein beträchtlicher Anteil von humoralen Abstoßungen tatsächlich DSA–/C4d– ist. Was natürlich zur Frage führt (sofern die Nomenklatur noch korrekt ist), was das für Antikörper sein könnten, die weder in der Zirkulation noch in den Kapillaren nachweisbar sind. Non-HLA-Antikörper, Autoantikörper oder womöglich in situ produzierte Antikörper?
In die Lücke, die von den DSA+/C4d+-Abstoßungen hinterlassen wurde, sind sehr schnell die Natürliche Killer(NK)-Zellen gestoßen. Diese Zellen – seit jeher enigmatisch und im Grenzgebiet zwischen angeborener und erworbener Immunität operierend – nahmen plötzlich eine raumgreifende, prominente Rolle ein. Die Aufklärung des Aktivierungsprinzips („missing-self“ recognition) erfuhr hohe wissenschaftliche Aufmerksamkeit. Eine eindrucksvolle Studie mit RNA-Sequenzierung von Einzelzellen aus Transplantatbiopsien hat jüngst nachgewiesen, dass Fcγ-Rezeptor-IIIa-positive Monozyten und NK-Zellen eine zentrale Rolle im Entzündungsprozess spielen [6]. Die NK-Zellen können aber auch ADCC (antikörperabhängige zellvermittelte Zytotoxizität) nutzen und tun dies auch (Abb. 1).
Damit wird genau die Missing-self-Aktivierung bei der Transplantatabstoßung wieder in Frage gestellt bzw. relativiert. Bleibt die Frage: Welche Antikörper, von wem und wo produziert? Prompt geht es in die nächste Runde, und man versucht jetzt, bei der NK-Zell-Aktivierung den relativen Anteil von „missing-self“, von Antikörperbindung und anderen Mechanismen zu entschlüsseln [7].
Im Rahmen der oben zitierten Untersuchungen ist auch klargeworden, dass elaborierte molekularbiologische Systeme wie MMDx oder B-HOT nicht mehr von einzelnen Zentren vorgehalten werden können, sondern im Forschungsverbund eingesetzt werden. Ob und wann diese Technologien jemals in die klinische Routine gelangen und dann auch von einzelnen, kleineren Zentren genutzt werden können, ist derzeit noch offen.
Insgesamt erscheint es jedoch zu früh, die Dichotomie von T- und B-Zelle in der Transplantationsmedizin jetzt schonabzuschreiben.
Neue Therapieansätze
Der langjährige Erfolg der Standardimmunsuppression in der Transplantations-medizin beruht nicht zuletzt auf der lange Zeit unerkannten, engen Interaktion bei der T- und B-Zell-Aktivierung. Das heißt, gegen T-Zellen gerichtete Regimes supprimieren gleichzeitig auch die B-Zell-Reifung samt Antikörperproduktion, und umgekehrt inhibieren Anti-B-Zell-Regimes (vgl. CD20-Ak) T-Zellen. Im therapeutischen Arsenal hatte sich zuletzt daher nicht viel geändert. Neue Therapieansätze sind zeit- und kostspielig und benötigen vor der klinischen Anwendung eine längere Vorlaufzeit. Zwei Ansätze, die relativ schnell auf neue immunologische Erkenntnisse reagiert haben, verdienen deshalb Beachtung.
Eine bakterielle Endopeptidase (Imlifidase) kann IgG-Moleküle spalten und inaktivieren. Damit ist es möglich, hochsensibilisierte Empfänger erfolgreich zu transplantieren [8]. Der Effekt ist allerdings zeitlich begrenzt, die Gabe von Imlifidase stellt somit keine Dauertherapie dar. Anders verhält es sich mit einem monoklonalen Antikörper gegen CD38, der ein Oberflächenmolekül auf Plasmazellen und NK-Zellen attackiert und deshalb das Potenzial hat, auch chronisch-humorale Abstoßungen der Kategorie (DSA–/C4d–) zu verhindern [9].
Deep Learning in der Pathologie
In den 1990er-Jahren wurde verfügbares, relevantes Wissen besonders in der Pathologie über längere Zeit ignoriert (siehe interstitielle Kapillaren in Niere und Herz; „microvascular inflammation“; C4d). Fehler dieser Art werden unwahrscheinlicher, denn bei der Auswertung von Transplantatbiopsien kann neuerdings Künstliche Intelligenz (KI) helfen. Mithilfe von Convolutional Neural Networks können große Bildmengen verarbeitet, deren Inhalte erlernt und dann im Einzelfall angewendet werden – weshalb diese Technik zuerst in der Radiologie zum Einsatz gekommen ist. Natürlich bieten sich auch histologische Schnitte zur Auswertung an. So kann durch KI bereits eine individuelle Präklassifizierung erfolgen in die Kategorien: normal – Abstoßung – andere Erkrankungen [10]. Als weiteres (neben der angestrebten Qualitätsverbesserung) verblüffendes Argument für den Einsatz von KI wird tatsächlich der beklagte „Fachkräftemangel“ in der Nephropathologie angeführt. Demnach können bald auch Patholog:innen, deren Hauptinteresse nicht den Nieren gilt, so zu einer validen Diagnose gelangen.
Nichtinvasives immunologisches Monitoring
Ein zuverlässiger, nichtinvasiver Test zum immunologischen Monitoring eines Transplantats – und damit zur individuellen Steuerung der Immunsuppression – wäre unbedingt willkommen. Es ist ein Rätsel, warum es bisher kein einziger Test in die klinische Routine geschafft hat, trotz etlicher guter Ansätze. In der Nierentransplantation bietet sich seit jeher der Urin (sofern er produziert wird) als Substrat für alle möglichen Entzündungsprozesse an. Zum Beispiel galt die RNA-Analyse in Urinzellen als äußerst vielversprechend und wurde als Vorstufe für den „Rejectostix“ vor Jahren bereits im New England Journal gefeiert [11]. Derzeit ist die Liquid Biopsy mit Bestimmung der zellfreien DNA des Donors im Empfängerblut hoch im Kurs. Alle diese Biomarker werden aber laut Science [12] im Tierexperiment von der guten alten Temperaturmessung aus dem Feld geschlagen. Tatsächlich scheint die fortlaufende Messung der Transplantat-temperatur den größten prädiktiven Wert zu haben. Dafür bräuchte es allerdings eine High-Tech-Vorrichtung mit implantierbaren Bioelektroden.
„Xenotransplantation is the future, and always will be”
Dieses berühmte Bonmot von Norman E. Shumway aus Stanford, CA/USA, hat soeben seine Gültigkeit verloren. In den vergangenen beiden Jahren wurden sowohl genetisch veränderte Schweineherzen als auch Schweinenieren in Menschen transplantiert. Die Operationen können als Meilensteine in der jüngeren Geschichte der Xenotransplantation gelten.
Die Transplantation eines solchen Schweineherzens in einen todkranken Patienten ist dramatisch verlaufen. Nach anfänglich hoffnungsvollem Kurs ist es nach 60 Tagen zu einem akuten, ungewöhnlichen Transplantatversagen gekommen [13]. Mehrere Faktoren haben zu einer schweren Kapillarschädigung mit nachfolgender ödematöser Myokardnekrose geführt (das Herz hatte zuletzt sein Gewicht fast verdoppelt). Infrage kamen dabei eine CMV-Reaktivierung im Herzen (wohlgemerkt keine Zoonose, da das porcine CM-Virus im Schweineherzen verblieben und nicht auf den Empfänger übergesprungen ist), eine humorale Abstoßung mit „exogener“ Komponente (die hochdosiert verabreichten, intravenösen Immunglobuline haben auch Anti-Schwein-Antikörper enthalten), zudem mehrere Infektionen oder alles zusammen.
Schließlich hat Robert A. Montgomery (er ist selbst herztransplantiert und verfolgt auch ungewöhnliche Wege) je eine Schweineniere in zwei hirntote „Empfänger“ verpflanzt und über einen Zeitraum von 54 Stunden überwacht bis zur Explantation [14]. Eine umfassende histologische und molekularbiologische Analyse der gut funktionierenden Organe hat nun ergeben, dass die gegenwärtigen genetischen Veränderungen der Organe zwar ausreichend vor einer hyperakuten Abstoßung schützen, aber wohl nicht hinreichend sind, um eine schleichende humorale Abstoßung auf Dauer verhindern zu können [15]. Weitere Modifikationen – auch in der Immunsuppression – sind also notwendig.
Davon offenbar unbeeindruckt hat soeben ein Team am Massachusetts General Hospital, MA/USA, einem Dialysepatienten erfolgreich eine mit 69 genomischen Veränderungen ausgestattete Schweineniere [16] eingepflanzt. Damit ist die Xenotransplantation nun endgültig in der Gegenwart angekommen.