Fäkaler Mikrobiomtransfer bei GvHD und Komplikationen nach allogener Stammzelltransplantation - Ein vielversprechender Ansatz
DOI: https://doi.org/10.47184/td.2024.02.02Die akute Graft-versus-Host-Erkrankung ist eine häufige und bei einigen Betroffenen immer noch letale Komplikation der allogenen Stammzelltransplantation. In den vergangenen zehn Jahren stellte sich eine massive Reduktion der Diversität intestinaler Mikrobiota mit Suppression der kommensalen Bakterien und der daraus resultierende Verlust ihrer protektiven Metabolite als ein wesentlicher Risikofaktor heraus. Seit 2016 wurden aufbauend auf diesen Befunden einige Studien publiziert, die positive Effekte des fäkalen Mikrobiomtransfers nach allogener Stammzelltransplantation zeigten. Er wurde mit verschiedenen Zielsetzungen eingesetzt: 1) um Antibiotika-resistente Bakterien zu eliminieren, 2) zur Wiederherstellung der mikrobiellen Diversität nach erfolgreicher Erholung der Hämatopoese und 3) vor allem zur Behandlung Kortikosteroid-resistenter Graft versus Host Disease. Insgesamt wurden Ansprechraten von 30 bis 55 % berichtet, wobei randomisierte Studien noch ausstehen. Als weitere Entwicklung wird derzeit der prophylaktische fäkale Mikrobiomtransfer zur Vermeidung von Graft versus Host Disease und anderer Komplikationen evaluiert. Trotz der schweren Immunsuppression bei Personen mit allogener Stammzelltransplantation sind bisher keine wesentlichen – insbesondere infektiösen – Komplikationen aufgetreten. Der fäkale Mikrobiomtransfer ist ein aussichtsreicher Ansatz zur Modulation der Graft-versus-Host-Erkrankung nach allogener Stammzelltransplantation und sollte früher im Verlauf und in randomisierten Studien evaluiert werden.
Schlüsselwörter: Akute Graft-versus-Host-Erkrankung, aGvHD, fäkaler Mikrobiomtransfer, FMT, Dysbiose, Antibiotika-Gabe
Die allogene Stammzelltransplantation (aSZT) ist eine wichtige Behandlungsmethode hämatologischer Neoplasien wie zum Beispiel akuter Leukämien und myelodysplastischer Syndrome, die durch klassische Ansätze wie Chemo- und Immunotherapie nicht ausreichend geheilt werden können. Der guten Heilungschance steht aber ein hohes Risiko immunologischer Komplikationen insbesondere durch die Graft-versus-Host-Erkrankung (GvHD) – einer Reaktion der Spenderlymphozyten gegen den Empfänger – gegenüber, die zu erheblicher Morbidität und – je nach Stadium – bei aSZT immer noch bei 10 bis 30 % der Betroffenen zur therapieassoziierten Mortalität (TRM) führt. Die Herausforderung bei der aSZT ist es dabei, die gefährliche GvHD vom erwünschten immunologischen Effekt der Spenderlymphozyten gegen die Leukämie, der Graft-versus-Leukämie-Reaktion, zu trennen. Bei der akuten Graft-versus-Host-Erkrankung (aGvHD) sind Haut, Leber und Gastrointestinaltrakt die Hauptzielorgane, wobei die aGvHD des unteren Gastrointestinaltrakts die gefährlichste Manifestation und – falls refraktär auf Steroid-Therapie – mit einer TRM von 60 bis 80 % assoziiert ist [1].
Aus pathophysiologischer Sicht kann die Interaktion mit den Mikrobiota die hohe Anfälligkeit von Haut und Gastrointestinaltrakt für die GvHD erklären. In den frühen 1970er-Jahren stand dabei als Erklärung die Kostimulation der Alloreaktion durch die intestinale Flora im Vordergrund, da keimfrei gehaltene Mäuse deutlich weniger aGvHD zeigten [2]. Basierend auf diesen Ergebnissen galten deshalb lange Zeit auch klinisch strikte Dekontamination und antibiotische Infektionsprophylaxe vor allem in der frühen Phase der Neutropenie als Standard [3]. Mit der Möglichkeit der 16S-Sequenzierung intestinaler Mikrobiota wurde aber klar, dass diese Maßnahmen selten zur kompletten Dekontamination, sondern meist zur schweren Dysbiose mit Verlust protektiver Bakterien führen, die die aGvHD sogar fördert. Diese Befunde wurden zunächst in Single-Center Reports berichtet [4, 5] und später in Multicenterstudien bestätigt [6, 7]. Dabei wurde klar, dass die weltweit übliche massive Antibiotika-Exposition in der frühen Transplantationsphase mögliche ernährungsbedingte Unterschiede zwischen den Zentren überspielt.
Fäkaler Mikrobiomtransfer bei aSZT
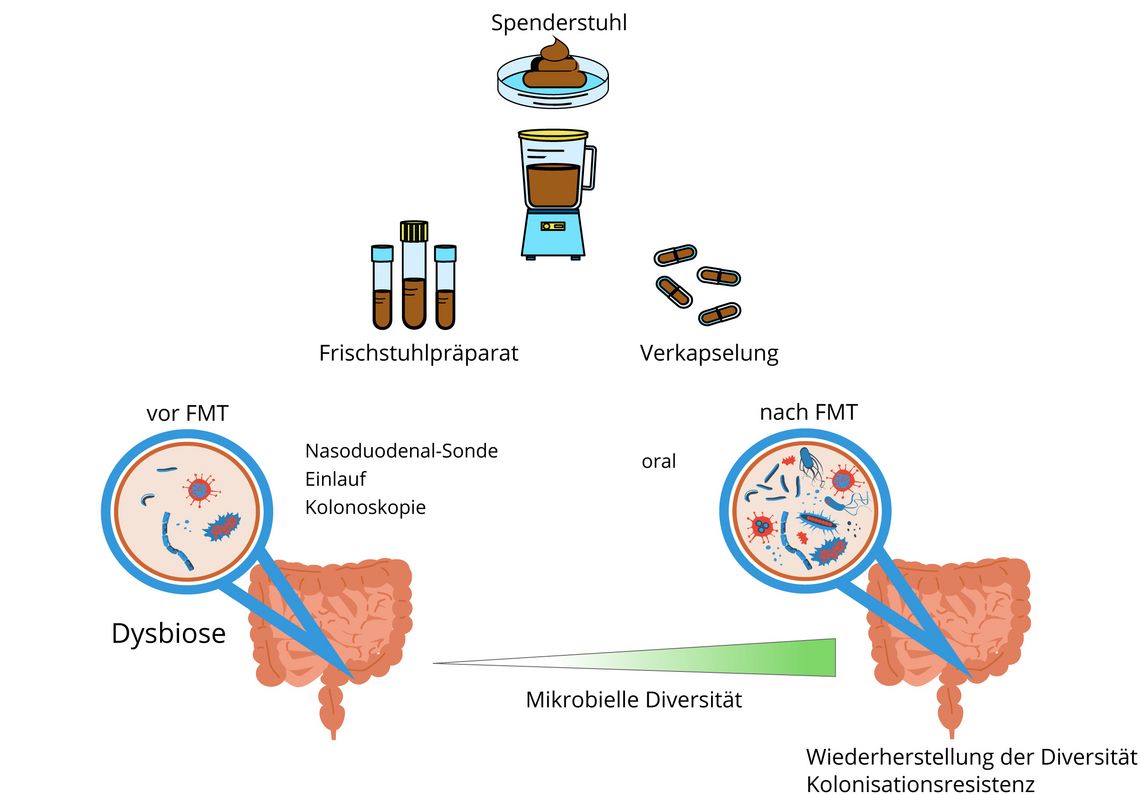
Wie bei anderen mit Dysbiose assoziierten Erkrankungen (z. B. der Inflammatory Bowel Disease; IBD) war es deshalb naheliegend, dass eine Korrektur der Dysbiose helfen könnte, eine schwere GvHD im Gastrointestinaltrakt zu bekämpfen. Neben anderen Optionen wird der fäkale Mikrobiomtransfer (FMT) von gesunden Spendern als einer der erfolgversprechendsten Ansätze gesehen [8]. Drei Ansätze des FMT werden derzeit untersucht und im Folgenden diskutiert.
1) FMT zur Korrektur der Kolonisierung mit Antibiotika- bzw. multiresistenten Bakterien
Der FMT etablierte sich zunächst als erfolgreiche Behandlung der rezidivierten Clostridium-difficile-Infektion (CDI) bei nichthämatologischen Patient:innen. Bald legten erste Berichte zur FMT bei CDI unter Immunsuppression und nach SZT und Organtransplantation nahe, dass auch bei dieser vulnerablen Patientengruppe erfolgreiche FMTs ohne ein erhöhtes Risiko infektiöser Komplikationen durchgeführt werden können. 2016 berichteten Webb et al. [9] eine Heilung bei sechs von sieben CDI nach aSZT. 2017 publizierte Bilinski [10] Verläufe von 20 hämatologischen Patient:innen – davon sechs nach aSZT, die eine FMT zur Elimination Antibiotika-resistenter Bakterien (ARB; v. a. verschiedener ß-Laktamase-resistenter Stämme und von Vancomycin-resistenten Enterokokken; VRE) mit einem Ansprechen bei 75 % erhalten hatten. Battipaglia [11] publizierte eine erfolgreiche Dekolonisierung von Carbapenem-resistenten Bakterien und VRE bei sieben von zehn Patient:innen. Diese Ergebnisse wurden weiter bestätigt [12, 13] und legten den FMT als Alternative zu wiederholten Behandlungen mit Reserve-Antibiotika nahe. Eine Studie zum autologen FMT bei Personen mit akuten Leukämien mit dem Ziel der Korrektur der Dysbiose nach Chemotherapie und Neutropenie zeigte darüber hinaus, dass der FMT auch die häufige Zunahme von Resistenzgenen in der Phase der Neutropenien bei der Mehrzahl der Betroffenen rasch korrigieren konnte [14].
2) Prävention und Behandlung der Dysbiose nach aSZT
2018 sammelten Taur [15] et al. patienteneigene FMT-Produkte vor Aufnahme zur aSZT, um bei Auftreten einer Dysbiose das diverse Mikrobiom nach Erholung von der Neutropenie zu rekonstituieren. 15 Personen erhielten die sogenannte autologe FMT, elf Personen waren im Kontrollarm: Die Studie zeigte einen hochsignifikanten Effekt auf die Diversität auch unter Einbeziehung unterschiedlicher Diäten und supportiver Therapie. Ein Nachteil dieses Ansatzes ist allerdings, dass sich bei der Mehrzahl der Betroffenen keine autologen FMT-Produkte vor der aSZT gewinnen lassen, weil viele von ihnen bereits einen anhaltenden Mikrobiomschaden durch die Antibiotika-Gaben während der vorhergehenden Leukämie-Therapie aufweisen.
DeFillip et al. [16] setzten in einer einarmigen Studie FMT-Kapseln von gesunden Donoren bei Erkrankten nach Erholung der Blutbildung nach aSZT zur Korrektur der Dysbiose ein. Bei 13 von 18 Personen war diese Intervention möglich, fünf mussten wegen früher Darm-GvHD oder anderer Toxizität ausgeschlossen werden. Bei den 13 Behandelten ließ sich die Diversität deutlich verbessern mit Expansion der Spender-Mikrobiota und nur zwei entwickelten später eine Darm-GvHD; die TRM war mit 8 % extrem niedrig.
2023 präsentierte Rashidi die erste randomisierte Studie mit FMT-Kapseln zur Rekonstitution der Mikrobiomdiversität nach Engraftment [17]. Das primäre Studienziel der Reduktion von Infektionen in den ersten vier Monaten wurde mit einer Ratio von 0,83 zwischen FMT und Kontrollen zwar nicht erreicht, allerdings ließ sich bei besserer Diversität in der FMT-Gruppe die Abundanz pathogener Bakterien, zum Beispiel Enterokokken, reduzieren. In einer aktuellen Subgruppenanalyse wurde zudem gesehen, dass Betroffene mit späterer Darm-GvHD einen stärkeren Diversitätsverlust haben, sodass diese Gruppe besonders von einer FMT profitieren könnte [18].
3) Behandlung der aGvHD
Aufgrund der klaren Assoziation zwischen Dysbiose und aGvHD waren die ersten Pilotstudien seit 2016 auf die Behandlung der Steroid-refraktären GvHD fokussiert: Kakihana (2016 [19]) und Spindelboeck (2017 [20]) behandelten vier bzw. drei Betroffene mit Steroid-resistenter bzw. -abhängiger GvHD mit FMT (endoskopisch bzw. über Duodenal-Sonde) von verwandten oder unverwandten gesunden Spendern. Die meisten Betroffenen benötigten mehrere FMT-Gaben vor Eintritt einer klinischen Besserung; schwerwiegende Infektionen wurden trotz der fortgeschrittenen GvHD nicht beobachtet. In beiden Studien wurde als Ausdruck des Ansprechens ein Anstieg des Verhältnisses von regulatorischen zu zytotoxischen Effektorzellen im Blut bzw. in Biopsien beobachtet [20, 21]. Seit diesen Pilotstudien berichteten zahlreiche Arbeiten (Tab. 1) ein Ansprechen der aGvHD auf FMT bei ca. 50 % der Proband:innen.
Tab. 1: Überblick von Studien zum Ansprechen der aGvHD auf FMT.
ABR = antibiotic-resistant bacteria, CR = complete response, CCR = complete remission, GvHD = graft versus host disease, OR = odds ratio, ORR = overall response rate, PR = partial remission, TRM = transplantation related mortality/morbidity, SR = steroid resistant, SD = steroid dependent.
Publikation | FMT-Spende | Indikation/ Zeitpunkt | Anzahl Behandelter | Anzahl Kontrollpersonen | Outcome |
|---|---|---|---|---|---|
Kakihana 2016 [20] | allogen | SR/SD GvHD | 4 | – | 3 CR/1 PR |
Spindelboeck 2017 [21] | allogen | SR GvHD | 3 | – | 2 CR/1 PR |
Bilinski 2017 [11] | allogen | ABR-Kolonisierung | 20 | – | Dekolonisation bei 75 % |
Taur 2018 [16] | autolog | nach Engraftment | 14 | 11 | Diversität wiederhergestellt |
Kaito 2018 [33] | allogen | SR GvHD | 1 | – | weniger Diarrhö |
De Filipp 2018 [17] | allogen | nach Engraftment | 13 | – | Diversität wiederhergestellt, nur 8 % TRM |
Battipaglia 2019 [12] | allogen | ABR-Kolonisierung | 10 | – | Dekolonisation in 7 von 10 |
Goloshchap 2020 [34] | allogen | SR GvHD | 19 | 8 | OR nach FMT d30 n = 8, d90 n =16, OR nur ein Kontrollpatient |
Mao D 2020 [35] | allogen | SR GvHD | 1 | – | Ansprechen |
Biernat 2020 [36] | allogen | SR GvHD | 2 | – | CR bei einem Patienten |
Van Lier 2020 [23] | allogen | SR/SD GvHD | 15 | – | CCR bei 10 von 15 |
Zhao 2021 [37] | allogen | SR/SD GvHD | 23 | 18 | besseres Überleben bei FMT (p = 0,02) |
Su F 2021 [14] | allogen | ABR-Kolonisierung | 1 | – | Dekolonisation |
Spindelboeck 2021 [22] | allogen | SR GvHD | 9 | – | OR bei 4 von 9, ABX-Gabe verhindert Response |
Goeser 2021 [24] | allogen | SR GvHD | 11 | – | weniger Diarrhö |
Innes 2021 [13] | allogen | ABR-Kolonisierung | 10 | – | Dekolonisation bei 25 %, Outcome verbessert |
Liu 2022 [38] | allogen + Ruxo | SR GvHD | 21 | – | Response bei 71 %, CCR bei 10 von 21 |
Zheng 2023 [25] | allogen | SR/SD GvHD | 19 | 10 | CR bei 10 von19 vs. 2 von 10 |
Rashidi 2023 [18] | allogen | nach Engraftment | 50 | 24 | keine signifikante Reduktion von Infektionen |
Malard 2023 [26] | allogen | SR GVHD | 24/52 | – | ORR 38 %/58 % |
In der Studie von van Lier sprachen zehn von 15 Personen an und zeigten ein verbessertes Zwei-Jahres-Überleben [22]. Goeser et al. [23] behandelten elf Personen mit Steroid-resistenter GvHD mit unterschiedlichen FMT-Ansätzen. Sie sahen signifikantes Ansprechen des Stuhlvolumens, fordern aber zur Bestätigung prospektive randomisierte Studien. In kleinen Studien mit Kontrollgruppen [24] war der FMT jeweils überlegen. Die größte Gruppe Steroid-refraktärer mit FMT behandelter GvHD-Patient:innen wurde in der prospektiven Heracles-Studie von F. Malard 2023 publiziert [25]: Die Patient:innen erhielten ein Multidonor-FMT-Produkt mit sehr hoher Diversität einer französischen Firma. Bei 24 Studienteilnehmenden lag die gastrointestinale Ansprechrate bei 38 %; zusätzlich wurden 52 Personen in einem Extended-Access-Programm behandelt; sie zeigten sogar eine Response-Rate von 58 % mit einem Zwölf-Monats-Überleben bei einem Drittel der Betroffenen. Bei insgesamt fünf Personen traten infektiöse Komplikationen auf; allerdings konnten bei keiner von ihnen molekular Bakterien des gespendeten FMT-Produkts nachgewiesen werden.
Probleme der bisherigen Studien und Ausblick
Die hohe Anfälligkeit für bakterielle Infektionen, speziell in der neutropenen Phase nach intensiver Konditionierung und/oder bei früher GvHD, hat dazu geführt, dass bisher alle Ansätze der FMT bei aSZT aus Sicherheitsgründen erst nach Erholung der neutrophilen Granulozyten im Blutbild durchgeführt wurden. In dieser Situation war die Anwendung der FMT in der Regel sicher; allerdings wurde einmalig bei einem aSZT-Patienten die Übertragung Multidrug-resistenter Bakterien durch ein prophylaktisch verabreichtes FMT-Produkt berichtet [26].
In der Prä- und frühen Posttransplantationsperiode erhalten die Betroffenen sehr häufig prophylaktisch oder therapeutisch Antibiotika, die oft über das Engraftment hinaus auch in der Periode der Manifestation der aGvHD fortgeführt werden. Deshalb wurden in allen bisher berichteten Studien FMTs auch unter variabler Antibiotika-Exposition gegeben – meist mit dem Effekt eines schlechteren Ansprechens. Gegenwärtig werden verschiedene Strategien diskutiert, wie man das Problem der Interferenz von Antibiotika und FMT mildern könne, am häufigsten wurden zusätzliche FMTs nach Absetzen der Antibiose gegeben. Hier wäre für die Vergleichbarkeit der FMT-Ansätze dringend eine Standardisierung des Vorgehens bei mit Antibiotika behandelten Patient:innen wünschenswert. Wichtig ist auf jeden Fall ein restriktiver Einsatz von Antibiotika unter entsprechender Antibiotic Stewardship; Beispiele sind hier der Verzicht auf Antibiotika bei Fieber durch eindeutiges Zytokin-Freisetzungssyndrom (Cytokine Release Syndrome; CRS) [27], wobei CRS und infektiöses Fieber klinisch häufig schwer zu unterscheiden sind. Als weiterer Ansatz wird derzeit die selektive Inaktivierung von Antibiotika im Gastrointestinaltrakt untersucht [28].
Angesichts der Möglichkeit eines bereits irreversiblen und dann eventuell auch durch FMT nicht mehr reparablen Darmschadens bei Steroid-resistenter aGvHD wird überlegt, den Mikrobiomschaden möglichst prophylaktisch zu korrigieren. Neue Studien zeigen, dass bereits ein Diversitätsverlust bei Aufnahme zur aSZT ein Risikofaktor für eine höhere Komplikationsrate nach aSZT ist [7, 29]. Aktuell laufende Studien starten deshalb mit oralen FMT-Gaben vor der Konditionierung und Neutropenie, unterbrechen sie und nehmen die Applikation nach Engraftment der Blutbildung wieder auf. Als weitere Alternative wird der Biomarker-getriggerte frühe Einsatz der FMT zur Primärtherapie der aGvHD bei Hochriskopatient:innen entwickelt. All diese Ansätze sollten möglichst in prospektiven randomisierten Studien untersucht werden; die ersten laufenden Studien dieser Art werden nicht vor Ende 2026 verfügbar sein.
Auch wenn die Ansätze mit FMT bei aSZT durchaus erfolgversprechend sind, kann nicht erwartet werden, dass die FMT alleine kurativ wirkt. Alloreaktive T-Zellen sind die primäre Ursache der GvHD, während Mikrobiota vor allem zu der von P. Reddy postulierten Tissue Tolerance beitragen [30]. In einer Studie an gastrointestinalen Biopsien konnten wir zeigen, dass kommensale Bakterien regulatorische T-Zellen unterstützen, die mit den GvHD verursachenden klonalen CD8-Zellen interagieren, und dass ein FMT die engere Interaktion dieser Zellen fördert [31]. Schließlich hängt auch von der Klärung des Wirkmechanismus der FMT ab, welche Verfahren sich in Zukunft durchsetzen werden. Andere und wir beobachteten, dass protektive Metaboliten von Bakterien wie kurzkettige Fettsäuren und Indole wichtig für die Protektion sind [32]. Dementsprechend ist die Weiterentwicklung der FMT zur Gabe von Metaboliten-Cocktails auch bei aSZT vorstellbar.
Förderung
- EH, EM, HP, ETO: DFG CRC1371 (Microbiome signatures – funktionale Relevanz im Gastrointestinaltrakt)
- ETO: DGIM Clinician Scientist Programm
- EH, DW, AG, AH, HP: DFG TR221 GvH/GvL
- EH, DW: José Carreras Leukämie-Stiftung, Grant DLCS 01 GvHD/2020