Fortschritte und Herausforderungen der Alzheimer-Diagnostik: Blutbasierte Biomarker auf dem Vormarsch?
DOI: https://doi.org/10.47184/td.2025.01.07Die bisher in Leitlinien empfohlenen Verfahren zur Diagnose einer Alzheimer-Erkrankung sind unter anderem entweder zu unspezifisch bzw. zu teuer oder im Falle der liquorbasierten Diagnostik zu invasiv. Blutbasierte Biomarker wie Amyloid-beta und Tau-Proteine oder in Zukunft auch microRNA und OMICs-Ansätze könnten hier Abhilfe schaffen. Ihrem Einzug in die Routine stehen jedoch derzeit noch Herausforderungen wie die Standardisierung von Analysemethoden sowie die Evaluation der Spezifität im Wege.
Schlüsselwörter: Morbus Alzheimer, Aβ-42, Aβ-40, p-Tau217, p-Tau181, p-Tau231, NfL, GFAP
Die Alzheimer-Krankheit (AD) ist eine der häufigsten neurodegenerativen Erkrankungen und stellt eine erhebliche Herausforderung für das Gesundheitswesen dar. Die Bedeutung einer frühzeitigen und präzisen Diagnose ist entscheidend für therapeutische Interventionen und die Patientenversorgung.
Traditionelle diagnostische Methoden wie die Erfassung klinischer Symptome, die Analyse von Liquorflüssigkeit (CSF) und bildgebende Verfahren sind Bestandteil der leitliniengerechten Diagnostik zur Abklärung einer Demenz-Erkrankung. Aus Liquor ist die Interpretation der Biomarkermuster mit einem etablierten Algorithmus (Erlangen-Score) schon lange etabliert [1]. Die daraus resultierende Befundnomenklatur wurde kürzlich von einem internationalen Expertengremium vereinheitlicht [2].
Ergänzend wird die blutbasierte Laboranalytik von serologischen und klinisch-chemischen Parametern wie beispielsweise Blutbild, Elektrolyte, Glukose, C-reaktives Protein (CRP) und Thyroidea-stimulierendes Hormon (TSH) aufgrund der hohen klinischen Relevanz zum Ausschluss einer reversiblen Demenzursache empfohlen. Diese etablierten Diagnosestrategien haben aber jeweilige Einschränkungen – diese sind in Tab. 1 zusammengefasst.
Tab. 1: Leitlinienempfehlungen zur diagnostischen Abklärung einer Demenz-Erkrankung [3].
Diagnoseverfahren | Einschränkungen |
|---|---|
Klinisches Bild | Unspezifisch und wenig sensitiv |
Bildgebung | Teuer und nur eingeschränkt verfügbar |
Liquoranalytik: Biomarker | Invasive Probengewinnung |
Blutanalytik: klinisch-chemische Routineparameter | Unspezifisch; Ausschluss einer reversiblen Demenzursache |
Im Gegensatz hierzu gibt es neue blutbasierte Biomarker zur Diagnostik einer primären Demenz wie der Alzheimer-Krankheit. Allerdings ist die Evidenz noch ungenügend, und Empfehlungen für einen breiteren Einsatz gibt es bisher noch keine. Das gilt auch für die isolierte Bestimmung des Apolipoprotein-E-Genotyps als genetischer Risikofaktor, der aufgrund mangelnder diagnostischer Trennschärfe und prädiktiver Wertigkeit im Rahmen der Diagnostik nicht empfohlen wird [3].
Aktuelle Studien zu neuen Therapieansätzen mit Biologika belegen, dass insbesondere bei der Alzheimer-Krankheit eine Behandlung schon in einem frühen Krankheitsstadium initiiert werden sollte [4]. Daher gibt es ein großes Interesse, mit blutbasierter Diagnostik von hoher Spezifität und Sensitivität eine einfache und kostengünstige Möglichkeit anzubieten, um Risikopatient:innen, die von einer Therapie profitieren könnten, rechtzeitig zu identifizieren [5]. Die Weiterentwicklung von ultrasensitiven Detektionsmethoden wie der Single Molecule Array-Technologie (SIMOA) oder von Chemilumineszenz-Immunoassays (CLIA) hat die technischen Voraussetzungen zur Detektion von neurodegenerativen Markern im Blut geschaffen. Die Empfehlungen der globalen Alzheimer-Initiative zu blutbasierten Biomarkern fordern eine diagnostische Sensitivität von ≥ 90 % mit einer Spezifität von ≥ 85 % in der Primärversorgung sowie ≥ 75 bis 85 % in der Sekundärversorgung [6].
Neuronale Proteine wie Amyloid-beta (Aβ1-40 und Aβ1-42) und Tau (Gesamt-Tau und phospho-Tau) werden für die Diagnosefindung und -abgrenzung bei der Alzheimer-Demenz routinemäßig aus Liquorproben bestimmt. Mittlerweile stehen kommerzielle Messmethoden zur Verfügung, welche eine sichere Quantifizierung dieser Biomarker auch aus Blutproben ermöglichen. In ersten Vergleichsstudien konnte gezeigt werden, dass die blutbasierte Diagnostik von neurodegenerativen Erkrankungen der Liquoruntersuchung zum Teil ebenbürtig ist [7, 8].
Allerdings sind die Cut-off-Werte von bestimmten Einflussgrößen wie Alter, Geschlecht, Body Mass Index (BMI) und Nierenfunktion sowie anderen Grunderkrankungen wie etwa Apoplex und Myokardinfarkt abhängig. Sie müssen daher immer im Zusammenhang mit weiteren Befunden bewertet werden [9].
In diesem Beitrag sind die wichtigsten Biomarker im Blut zur Diagnostik der Alzheimer-Krankheit kurz dargestellt, die sich aus dem pathophysiologischen Zusammenhang der Erkrankung ableiten lassen (Abb. 1) [10].
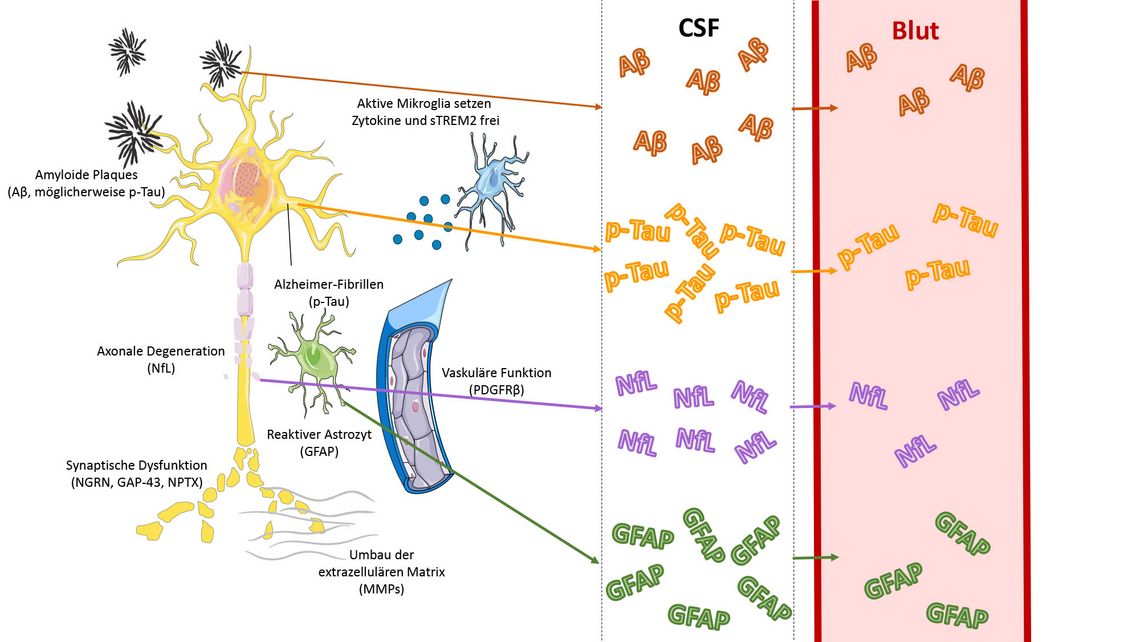
Abb. 1: Pathologische Mechanismen der Alzheimer-Krankheit und die damit verbundenen Biomarker in Bioflüssigkeiten. Amyolid-beta (Aβ), Neurofilament-Leichtkette (NfL), phosphoryliertes Tau (p-Tau), gliales fibrilläres saures Protein (GFAP) und Matrixmetalloproteinasen (MMP). Bild nach [10]: Autor/Trillium, Bildelemente von smart.servier.com.
Amyloid-beta als diagnostischer Marker
Amyloid-beta (Aβ) spielt eine zentrale Rolle in der Pathophysiologie der Alzheimer-Erkrankung. Die Akkumulation von Aβ-Peptiden (insbesondere Aβ-42 und Aβ-40) führt zur Bildung von Plaques im Gehirn. Eine Reduktion des Aβ-42/Aβ-40-Verhältnisses in Liquor und Blut korreliert hier mit der Akkumulation von Amyloid [11, 12]. Allerdings war in den präklinischen oder Prodromalstadien der Alzheimer-Krankheit die Plasmakonzentration von Aβ-42 nur mäßig verringert, während die Aβ-40-Konzentration unverändert blieb. Höhere Aβ-Konzentrationen im Plasma (aber nicht im Liquor) wurden bei vaskulären Erkrankungen wie zerebralen Mikroblutungen, Bluthochdruck, Diabetes und ischämischen Herzerkrankungen beobachtet. Der geringe Fold Change der Amyloid-Biomarker im Blut führte bei kleinen Messvariationen (Impräzision oder Präanalytikfehler) zu diagnostischen Fehlklassifikationen und geringer Robustheit dieser Messungen im Plasma [13].
Tau-Proteine als Biomarker
Tau-Proteine sind zentrale Akteure in der Pathogenese der Alzheimer-Erkrankung. Hyperphosphoryliertes Tau (p-Tau) aggregiert und bildet Neurofibrillen, die mit kognitivem Verfall korrelieren. Verschiedene Formen von Tau, darunter p-Tau217, p-Tau181 und p-Tau231, konnten im Blut von AD-Patient:innen nachgewiesen werden [14]. Die p-Tau-Biomarker zeigen eine hohe Spezifität und Sensitivität für die Diagnostik der Alzheimer-Erkrankung und korrelieren gut mit der Amyloid-Pathologie sowie dem kognitiven Status. Insbesondere p-Tau217 ist für die Klassifikation und Risikostratifizierung von Patient:innen mit leichter kognitiver Beeinträchtigung (MCI) geeignet [15]. Die blutbasierte Diagnostik mit p-Tau217 ist dabei der Liquoruntersuchung ebenbürtig [7, 8]. Weiterhin ist auch ein Therapiemonitoring möglich, und bei der Therapie mit Donanemab kam es im longitudinalen Monitoring zu einer signifikanten Reduktion der p-Tau217-Konzentration im Plasma [16]. Schließlich zeigen automatisierte Verfahren zur Messung von p-Tau217 eine hohe analytische Präzision und diagnostische Genauigkeit für die Alzheimer-Krankheit [17].
Da für p-Tau217 noch keine Referenzpräparation verfügbar ist, sind methodenabhängige Varianzen zu beachten. Zudem sollte ein longitudinales Monitoring immer mit dem gleichen Test durchgeführt werden [18]. Bei der Interpretation der Ergebnisse ist ein Zwei-Cutpoint-Ansatz zu favorisieren, der eine gute diagnostische Genauigkeit bietet und gleichzeitig den potenziellen Schaden durch falsch-positive Ergebnisse minimiert [19].
Neurofilament-Leichtketten (NfL)
Während Amyloid-beta und Tau-Proteine spezifische Biomarker für die Alzheimer-Erkrankung sind, sind NfL unspezifische Marker für axonale Schädigung. Eine erhöhte Plasmakonzentration findet sich bei verschiedenen neurodegenerativen Erkrankungen wie beispielsweise der Amyotrophen Lateralsklerose oder der Multiplen Sklerose sowie bei zerebrovaskulären Erkrankungen oder Hirntraumata. Zur Abklärung einer kognitiven Störung (CI) wurden die Plasmabestimmung von NfL als Screening-Test sowie die konsekutive Messung von p-Tau217 im Sinne einer Stufendiagnostik vorgeschlagen [20].
Glial Fibrillary Acidic Protein (GFAP)
Als intermediäres Filamentprotein der Astrozyten wird GFAP bei neurodegenerativen und neuroinflammatorischen Prozessen freigesetzt. Wie NfL ist GFAP nicht spezifisch für die Alzheimer-Erkrankung, und die Bestimmung im Plasma hat im Vergleich zu p-Tau217 keinen Mehrwert bei der Diagnostik [21].
Weitere Protein-Biomarker
Andere diagnostische Targets wie der synaptische Biomarker ß-Synuclein [22] oder TDP-43 als Bestandteil von extrazellulären Vesikeln [23] sind weitere, vielversprechende Optionen, die aufgrund der komplexen und wenig robusten Analytik momentan noch keine Verbreitung haben. Deshalb werden sie hier lediglich erwähnt.
microRNA
microRNAs (miRNAs) sind kleine, nicht-kodierende RNA-Moleküle, die eine entscheidende Rolle in der Genregulation spielen. Veränderte miRNA-Profile wurden mit neurodegenerativen Erkrankungen in Verbindung gebracht. Insbesondere miR-125b, miR-146a und miR-155 sind bei Personen mit einer Alzheimer-Erkrankung signifikant dysreguliert [24]. Diese miRNAs sind an Entzündungsreaktionen, Tau-Phosphorylierung und Amyloid-beta-Metabolismus beteiligt. Der Nachweis von miRNAs im Blut stellt nicht nur eine vielversprechende Methode dar, um frühzeitig neurodegenerative Prozesse zu identifizieren, sondern bietet auch therapeutische Optionen [24].
Omics
Die Omics-Technologien ermöglichen eine umfassende Analyse von unterschiedlichen molekularen Strukturen wie Proteinen, Lipiden und Metaboliten im Blut. Unter Nutzung von Biomaterialsammlungen mit langem Follow-up und Bioinformatikwerkzeugen konnten so Risikoprofile für die Alzheimer-Erkrankung identifiziert werden [25, 26]. Diese können als Grundlage für die Identifikation und Validierung weiterer analytischer Targets dienen. Auch die diagnostische Nutzung der Omics-Profile als Ganzes ist denkbar, wenn die Biomarkermuster ausreichend robust reproduziert werden können. In jedem Fall ist aber eine gründliche, unabhängige Validation in prospektiven Studien erforderlich.
Zusammenfassung
Die blutbasierte Diagnostik der Alzheimer-Erkrankung hat in den vergangenen Jahren erhebliche Fortschritte gemacht. Tau-Proteine, beta-Amyloide, microRNAs und Omics-Technologien bieten vielversprechende Ansätze für eine frühe und nichtinvasive Diagnostik.
Trotzdem gibt es weiterhin große Herausforderungen, die neben präanalytischen Störfaktoren auch die Standardisierung von Analysemethoden umfassen, um eine bessere Vergleichbarkeit von Studienergebnissen zu gewährleisten. Außerdem müssen Einflussgrößen wie beispielsweise Alter, Geschlecht und Komorbidität bei der Interpretation der Ergebnisse berücksichtigt werden, und es muss die diagnostische Spezifität der Alzheimer-Biomarker gegenüber anderen neurodegenerativen Erkrankungen systematisch evaluiert werden.
Aktuell erfüllen einige der Biomarker wie beispielsweise p-Tau217 schon viele, aber nicht alle der oben genannten Voraussetzungen für eine breite Implementierung in diagnostische Algorithmen [10]. Daher sollten blutbasierte Biomarker der Alzheimer-Erkrankung nur in spezialisierten Einrichtungen angewendet und in Kombination mit anderen Befunden interpretiert werden. Zum jetzigen Zeitpunkt ist lediglich eine Ergänzung, aber kein Ersatz der liquorbasierten Routinediagnostik möglich. Insbesondere bei Personen ohne kognitive Beschwerden können blutbasierte Biomarker in der Primärversorgung noch nicht empfohlen werden.
Weitere Studien sind erforderlich, um die diagnostische Sensitivität und Spezifität dieser Marker zu validieren und um ihre Integration in klinische Routinen zu ermöglichen. Die Kombination verschiedener Biomarker wie auch die Weiterentwicklung von durch Künstliche Intelligenz gestützter Datenauswertung und -interpretation könnten in Zukunft die Diagnostik revolutionieren und eine personalisierte Medizin für Alzheimer-Patient:innen ermöglichen.
