Welche Rolle spielt das Komplementsystem in der Pathogenese schwerer Verlaufsformen von COVID-19?
Das Komplementsystem spielt eine zentrale Rolle bei schweren Verlaufsformen von verschiedenen Infektionskrankheiten wie etwa dem hämolytisch-urämischen Syndrom (HUS) bei EHEC-Infektionen und seinen atypischen Varianten (aHUS)[1]. Im Vordergrund des Geschehens steht eine thrombotische Mikroangiopathie auf der Basis einer Endothelschädigung und Plättchenaktivierung. Ähnliche Pathomechanismen sind offenbar auch für die Gefährlichkeit von SARS-CoV-2 verantwortlich. Daraus leiten sich interessante therapeutische und diagnostische Optionen ab.
Nach einem vorläufigen Bericht aus Wuhan bindet das virale N-Protein an den Komplement-Aktivator MASP 2 in der Lunge und anderen Organen[2]. Dies kann zur Überreaktion des Immunsystems mit der Folge eines atypischen, schwer behandelbaren Lungenversagens[3] und einer generalisierten Endotheliitis mit Mikrothrombosierung[4] führen. Im Mausmodell wird das schwere Lungenversagen[5] bei SARS-CoV-Infektion durch eine Aktivierung des Komplementfaktors C3 initiiert und durch Unterdrückung des C3-Gens verhindert.
Bislang ist unklar, warum dieser Pathomechanismus nur bei einigen wenigen Patienten zum Tragen kommt. Von anderen Komplement-abhängigen, schweren Lungenkrankheiten (aHUS) weiß man, dass Mutationen und Polymorphismen in diversen Genen des Komplementsystems die Überreaktion begünstigen[6].
Therapeutische Bedeutung
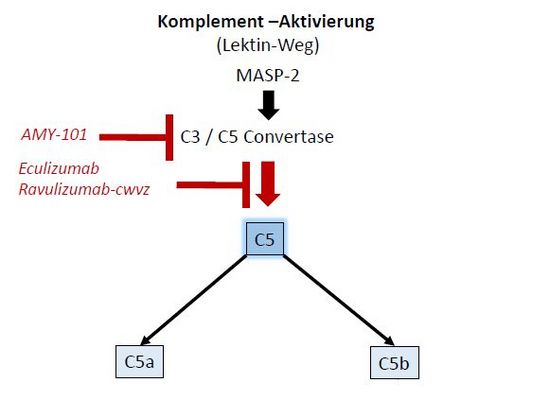
Die Behandlung schwerer COVID-19-Verlaufsformen konzentriert sich derzeit auf symptomatische und palliative Maßnahmen mit wenigen kausalen Ansätzen wie etwa der Antikoagulation mit niedermolekularem Heparin. In jüngster Zeit erschienen jedoch erste Berichte über die Wirksamkeit einer gezielt gegen die Komplementaktivierung gerichteten Therapie[7]. Beeindruckende Erfolge wurden in anekdotischen Fallstudien mit einem Hemmstoff der C3/C5 Convertase (AMY-101)[8] und einem monoklonalen Antikörper gegen den Komplementfaktor C5 (Eculizumab)[9] erzielt (Abb. 1). Beide Medikamente erwiesen sich als gut verträglich und führten in individuellen Heilversuchen („compassionate use“) zu einer bemerkenswerten Besserung der klinischen und radiologischen Lungenbefunde (Abb. 2). Eculizumab ist seit langem als Therapeutikum zur Langzeitanwendung (insbesondere bei der PNH) zugelassen und hat sich bei schweren Krankheitsbildern von aHUS[10] sowie bei Sepsis-induzierter Mikrothrombosierung[11] bewährt (wobei bakterielle Infektionen, insbesondere mit Meningokokken, auszuschließen bzw. antibiotisch zu behandeln sind). Ein Nachfolgemedikament Ravulizumab-cwvz wird derzeit in einer klinischen Studie bei COVID-19 getestet[12].
Abb. 1: Angriffspunkte von AMY-101 und Eculizumab / Ravulizumab-cwvz. (Bild: H.J. Kolde). Beide Wirkstoffe hemmen die Spaltung von Komplement C5 in die aktiven Peptide C5a und C5b. Diese sind verantwortlich für eine Vielzahl von Reaktionen im Rahmen der angeborenen Immunabwehr, z. B. Chemotaxis, Ausschüttung von Zytokinen, Produktion von Sauerstoffradikalen und Bildung des zytotoxischen Komplexes MAC (membrane attack complex). Bei überschießender Aktivierung können sich diese Reaktionen auf lokaler und systemischer Ebene gegen den eigenen Organismus richten, z. B. durch Bronchospasmen, Mikrothrombosierung, Auslösung des sog. Zytokinsturms sowie Lungen- und Multiorganversagen.
Diagnostische Bedeutung
Bei infizierten Klinikmitarbeitern am Wuhan Union Hospital wurden in 57% der (durchwegs leichten) Verläufe erniedrigte C3-Konzentrationen bei normalem C4 gefunden[13]. Dies kann als Hinweis auf eine Aktivierung des in Abb. 1 beschriebenen Lektin-Wegs der Komplementaktivierung gedeutet werden. Ansonsten erscheint das labordiagnostische Monitoring des Komplementsystems im Fall von COVID-19 bislang weitgehend als terra incognita. Systematische Messungen einschlägiger Analyte sind zu empfehlen.
Relativ einfach messbar sind beispielsweise C3, C3c und C4 mittels Turbidimetrie / Nephelometrie, ferner der C1-Inhibitor mit funktionellen, chromogenen und turbidimetrischen Tests. Der C-terminale membrane attack complex (sC56-9) als Endprodukt der Komplement-Kaskade erfordert aufwendigere ELISA- oder Hämolyse-Tests. Viele dieser Tests können auch in Rückstellproben durchgeführt werden.