Heparin-induzierte Thrombozytopenie (HIT) - Ein Update
DOI: https://doi.org/10.47184/td.2024.02.05Die Heparin-induzierte Thrombozytopenie ist eine immunvermittelte Arzneimittelreaktion, die mit schweren thrombotischen Komplikationen und mit einer hohen Morbidität und Mortalität einhergeht. Eine schnelle und genaue Diagnose ist entscheidend, um sowohl schwere thrombotische Komplikationen als auch eine risikoreiche Übertherapie mit alternativen Antikoagulanzien zu vermeiden.
Schlüsselwörter: HIT, Heparin, UFH, Thrombozytopenie, Thrombose, Labordiagnose, Antikörper
Die Heparin-induzierte Thrombozytopenie (HIT) ist eine potenziell lebensbedrohliche unerwünschte Arzneimittelwirkung, die mit Hyperkoagulabilität und einem hohen Thromboserisiko einhergeht. HIT ist jedoch eine seltene Erkrankung, und das Risiko, eine HIT zu entwickeln, variiert je nach Dauer und Art der Heparin-Exposition (3–5 % bei unfraktioniertem Heparin vs. 0,2 % bei niedermolekularem Heparin) sowie der Indikation für die Behandlung. Chirurgische (insbesondere kardiologische und orthopädische) oder unfallchirurgische Patient:innen haben ein deutlich höheres Risiko (1–5 %), eine HIT zu entwickeln, als medizinische oder intensivmedizinische Patient:innen (< 1 %) [1]. Die Erkrankung ist mit einer hohen Morbidität und Mortalität von bis zu 30 % assoziiert. Das typische klinische Bild der HIT ist eine moderate Thrombozytopenie, die sich fünf bis zehn Tage nach Beginn der Heparintherapie mit einem Nadir von 50 bis 80 × 109/l manifestiert [2]. Das Thromboserisiko kann jedoch schon vorher bestehen, da etwa die Hälfte der Betroffenen zum Zeitpunkt der Diagnosestellung thrombotische Komplikationen mit einer täglichen Inzidenzrate von etwa 6,1 % entwickelt [3]. Diese thrombotischen Ereignisse können sowohl arterieller (z. B. Extremitätenarterienverschluss, Myokardinfarkt und Schlaganfall) als auch venöser Natur (z. B. tiefe Venenthrombose und Lungenembolie) sein [4]. Das Thromboserisiko bleibt auch nach Absetzen der Heparintherapie für mehrere Tage bestehen, kann aber durch die Verwendung alternativer Antikoagulanzien in therapeutischer Dosierung auf 0,6 % gesenkt werden [5].
Pathophysiologie
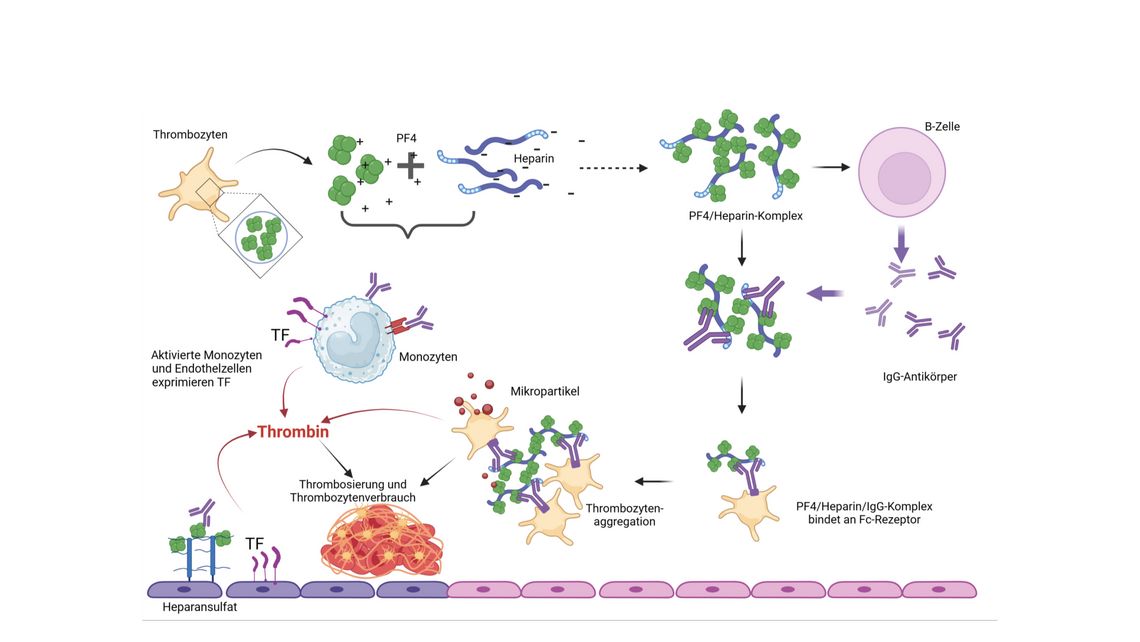
HIT ist eine Immunreaktion, die sich meist fünf bis zehn Tage nach der Exposition gegenüber Heparin durch die Bildung von Antikörpern gegen den PF4-Heparin-Komplex entwickelt. Thrombozytenfaktor 4 (PF4) ist ein positiv geladenes Protein, das in den Alpha-Granula der Thrombozyten gespeichert ist und während der Thrombozytenaktivierung freigesetzt wird. PF4 bindet und neutralisiert negativ geladene Heparinmoleküle, kann aber interessanterweise auch an andere negativ geladene Moleküle wie Nukleinsäuren oder Polysaccharide auf Bakterien binden. Dieses Phänomen könnte Fälle von spontaner oder autoimmuner HIT ohne Heparintherapie erklären [4]. IgG-Antikörper erkennen Neoepitope auf dem PF4-Heparin-Komplex und aktivieren Thrombozyten über deren zelluläre FcγRIIa-Rezeptoren. Diese Aktivierung führt zur Freisetzung von zusätzlichem PF4 und anderen prothrombotischen Mediatoren wie Gewebefaktor und prokoagulierenden Mikropartikeln und damit zu einer übermäßigen Thrombinbildung. In den vergangenen Jahren konnte gezeigt werden, dass HIT-Antikörper nicht nur Thrombozyten, sondern auch Monozyten, Neutrophile und Endothelzellen aktivieren (Abb. 1) [6].
Prädiktive Scoring-Systeme
Die HIT ist in erster Linie eine klinische Diagnose, sodass der klinischen Wahrscheinlichkeitseinschätzung vor der Labordiagnostik eine entscheidende Rolle zukommt. Sie ermöglicht einerseits eine rasche Therapieentscheidung bei hohem Risiko und kann andererseits eine kostenintensive Behandlung mit alternativen Antikoagulanzien mit deutlich erhöhtem Blutungsrisiko und fehlendem Antidot verhindern. Allerdings ist die Differenzialdiagnose der HIT gegenüber zahlreichen anderen Ursachen einer Thrombozytopenie bei heparinisierten Patient:innen oft schwierig (Tab. 1).
Tab. 1: Differenzialdiagnosen von Heparin-induzierter Thrombozytopenie.
Differenzialdiagnosen von HIT |
|---|
Sepsis |
Disseminierte intravaskuläre Gerinnung (DIC) |
Antiphospholipid-Syndrom |
Thrombotische Mikroangiopathie |
Purpura fulminans |
Infektiöse Endokarditis |
Thrombolytische Therapie |
Paroxysmale nächtliche Hämoglobinurie |
Purpura nach Transfusion |
Diabetische Ketoazidose |
Tumor-assoziierte DIC |
Lungenembolie |
Nicht immunvermittelte HIT |
GPIIb/IIIa-Inhibitor-induzierte Thrombozytopenie |
Postoperative Hemodilution |
Knochenmarksupression (toxisch, medikamentös) |
Medikamenteninduzierte Thrombozytopenie |
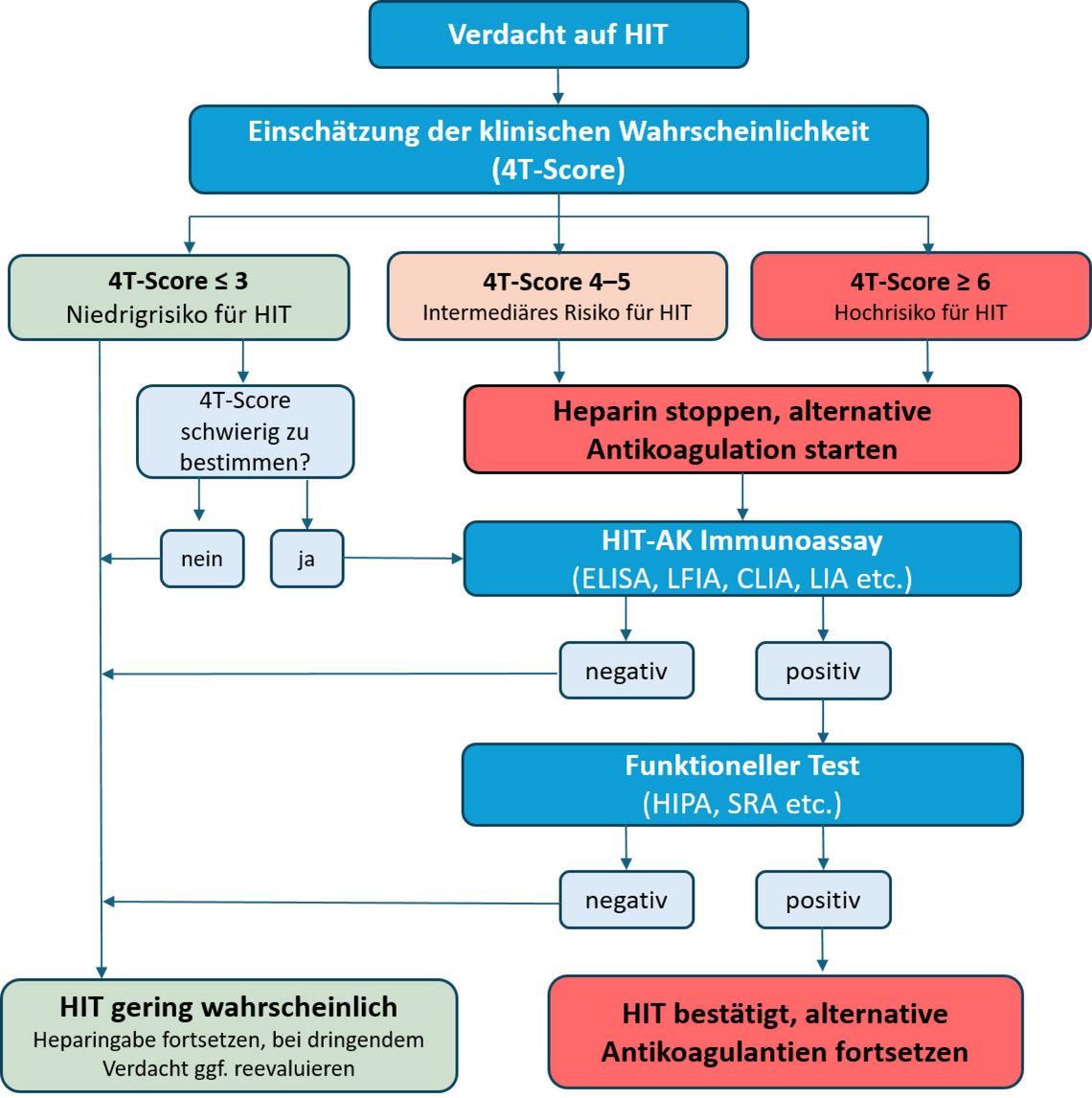
Der am häufigsten verwendete klinische Wahrscheinlichkeitsscore für HIT ist der von Warkentin et al. entwickelte 4T-Score [5]. Er vergibt Punkte für den Zeitpunkt des Beginns des Thrombozytenabfalls in Relation zur Heparin-Exposition (Timing), den Schweregrad der Thrombozytopenie (Thrombozytopenie), das Vorliegen einer bestätigten oder vermuteten thromboembolischen Komplikation (Thrombose) und die Wahrscheinlichkeit einer alternativen Ätiologie der Thrombozytopenie (oThers). In einer Metaanalyse lag der negative Vorhersagewert eines 4T-Scores mit niedriger Wahrscheinlichkeit 99,8 % (das heißt, ein niedriger Wahrscheinlichkeitswert schließt eine HIT zuverlässig aus). Die positiven Vorhersagewerte der mittleren und hohen Wahrscheinlichkeitswerte betrugen dagegen nur 14 bzw. 64 % [7].
Weitere klinische Scoring-Systeme sind der HIT Expert Probability (HEP) Score [8] und der Lillo-Le Louët Score für Patient:innen mit Thrombozytopenie nach kardiopulmonaler Bypass-Operation (CPB-Score) [9]. Der HEP-Score ist in der Anwendung komplexer als der 4T-Score, zeigt aber eine bessere Beurteilerübereinstimmung und Einschätzung des HIT-Risikos bei intensivmedizinischen Patient:innen auf [10]. Ein HEP-Score mit detaillierten Kriterien > 2 ergab eine Sensitivität von 100 %, aber nur 60 % Spezifität für die Diagnose einer HIT, während ein HEP-Score von 5 eine Sensitivität von 86 % und eine Spezifität von 88 % aufwies. Im Gegensatz dazu bewertet der CPB-Score nur drei unabhängige Parameter: die Thrombozytenzahl im Verlauf, die Zeit zwischen CPB und dem ersten Tag des Thrombozytenabfalls und die Dauer der CPB-Operation. Der Score zeigte einen guten negativen Vorhersagewert von 97 % und erwies sich bei erwachsenen herzchirurgischen Patient:innen im Vergleich zum 4T- und HEP-Score als effektiver [11]. Obwohl diese Scoring-Systeme vielversprechend sind, bedürfen sie weiterer prospektiver multizentrischer Validierung, bevor Empfehlungen zu ihrer Anwendung ausgesprochen werden können. Die aktuellen Leitlinien der American Society of Hematology (ASH) empfehlen im diagnostischen Algorithmus die Verwendung des 4T-Scores zur Abschätzung der klinischen Wahrscheinlichkeit sowie die Vermeidung des HIT-Labortests und der empirischen Behandlung von Patient:innen mit niedrigem 4T-Score [5] (Abb. 2).
Labordiagnostik
Die Labordiagnostik ist nach wie vor schwierig und basiert auf dem immunologischen Nachweis von Antikörpern gegen den PF4-Heparin-Komplex mit anschließender funktioneller Bestätigung des thrombozytenaktivierenden Potenzials der Anti-PF4-Heparin-Antikörper.
Zur Identifizierung und Quantifizierung von PF4-Heparin-Antikörpern wurden verschiedene Enzym-Immunoassays und schnelle Immunoassays entwickelt. Grundsätzlich haben die meisten Immunoassays eine hohe Sensitivität und einen hohen negativen Vorhersagewert (NPV) [12]. Neben den weitverbreiteten Enzym-Immunoassays (ELISA) gehören auch partikelbasierte Immunoassays (Partikel-Gel-Immunoassay; PaGIA), Lateral Flow Assays (LFIA) und schnelle Immunoassays zu dieser Kategorie. Vollautomatisierte rapide Immunoassays wie der Chemilumineszenz-Immunoassay (CLIA) und der Latex-Immunturbidimetrie-Assay (LIA) bieten eine Diagnosemöglichkeit on demand mit einer Analysezeit von weniger als 30 Minuten [13].
Es ist jedoch zu beachten, dass nicht alle PF4/Heparin-Antikörper Thrombozyten aktivieren und eine HIT auslösen können, was die Spezifität und den positiven Vorhersagewert (PPV) von Immunoassays einschränkt. Daher sollte ein positiver Antikörpernachweis durch einen funktionellen Test ergänzt werden, wofür verschiedene Thrombozytenaktivierungstests zur Verfügung stehen. Der Heparin-induzierte Plättchenaktivierungstest (HIPA) oder der Serotonin Releasing Assay (SRA) gelten aufgrund ihrer hohen Sensitivität und Spezifität (ca. 95 %) als Goldstandard für die Diagnose der HIT. Diese funktionellen Tests sind jedoch kosten- und zeitintensiv, technisch anspruchsvoll und erfordern ausgewählte Spender, die optimal auf die HIT-Antikörper reagieren. Sie werden daher nur in wenigen spezialisierten Laboren durchgeführt, was zu Analysezeiten von bis zu mehreren Tagen und zu einer verzögerten Diagnose der HIT führen kann. Eine vielversprechende Alternative bietet der neuartige durchflusszytometrische PF4-abhängige P-Selektin-Expression-Assay, der technisch weniger komplex als die Goldstandard-Assays ist, aber eine vergleichbare diagnostische Genauigkeit bietet [14, 15]. Dies sollte jedoch in zukünftigen prospektiven Studien im Vergleich zu den etablierten funktionellen diagnostischen Tests (HIPA und SRA) systematisch untersucht und validiert werden [16]. Tab. 2 fasst die wichtigsten Leistungsmerkmale verschiedener Labortests zusammen.
Tab. 2: Zusammenfassung der laboratoriumsmedizinischen Methoden zur Diagnose von HIT (modifiziert nach [12, 13]).
Assay-Typ | Antikörper-spezifität | Ergebnis | Zeit bis zum Ergebnis | Sensitivität | Spezifität | Bemerkungen |
|---|---|---|---|---|---|---|
Immunoassay Nachweis des Vorhandenseins von Anti-PF4/Heparin-Antikörpern | ||||||
ELISA | polyspezifisch | quantitativ | 3–4 h | 0,97 | 0,82 | begrenzte Spezifität, hohe Falsch-positiv-Rate, relativ zeitaufwendig |
IgG-spezifisch |
| 3–4 h | 0,98 | > 0,90 | Grad der Positivität ist mit der Wahrscheinlichkeit eines pathogenen HIT (OD-Werte > 2.0) verbunden | |
IgGAM-Partikel-Gel-Immunoassay (PaGIA) | polyspezifisch | qualitativ | 20 Min. | 1,00 | 0,90 | visuelle Beurteilung, Anwender- abhängig, ausgezeichneter NPV |
Lateral-Flow-Immunoassay (LFIA) | IgG-spezifisch | qualitativ | 15 Min. | 0,95 | 0,83 | visuelle Beurteilung, schlechte Reproduzierbarkeit zwischen Anwendern |
Chemilumineszenz-Immunoassay (CLIA) | polyspezifisch | quantitativ | 30 Min. |
|
| teuer, spezieller Analyzer, hoher NPV, Grad der Positivität kann mit der Wahrscheinlichkeit eines pathogenen HIT korrelieren |
IgG-spezifisch | quantitativ | 30 Min. | 0,98 | 0,98 | ||
Latex-Immunturbidimetrie-Assay (LIA) | polyspezifisch | quantitativ | 20 Min. | 0,95 | 0,95 | teuer, Grad der Positivität kann mit der Wahrscheinlichkeit eines pathogenen HIT korrelieren |
Funktionelle Assays Nachweis von Anti-PF4/Heparin-Antikörpern, die Thrombozyten binden und aktivieren können | ||||||
Serotonin-Freisetzungs-Assay (SRA) | 4 h | 1,00 | > 0,95 | Goldstandard, hochkomplex, zeitaufwendig, ausgewählte Spender erforderlich, erfordert die Verwendung von radioaktivem Material, Speziallabor | ||
Heparin-induzierte Thrombozytenaktivierung (HIPA) | 2–3 h | > 0,95 | > 0,95 | Goldstandard, zeitaufwendig, ausgewählte Spender erforderlich, gewaschene Spenderthrombozyten, Speziallabor | ||
Heparin-induzierte multiple Elektrodenaggregometrie (HIMEA) | 2–3 h | 0,81–0,90 | ~ 0,95 | eingeschränkte Sensitivität, ausgewählte Spender erforderlich | ||
Durchflusszytometrie | 2–3 h | 1,00 | 0,80 | ausgewählte Spender erforderlich, begrenzte Verfügbarkeit | ||
Lichttransmissionsaggregometrie (LTA) | 2–3 h | 0,69–0,85 | 1,00 | eingeschränkte Sensitivität, ausgewählte Spender erforderlich, PRP | ||
Diagnostische Instrumente der nächsten Generation
Die Implementierung einer klinischen Entscheidungshilfe (Clinical Decision Support; CDS) in die elektronische Patientenakte hat sich als wertvolles neues Diagnoseinstrument erwiesen [17]. Nilius et al. stellten kürzlich einen auf maschinellem Lernen basierenden Algorithmus für die Diagnose von HIT vor, der anhand einer prospektiven, multizentrischen Kohorte von 1.393 Patient:innen mit Verdacht auf HIT entwickelt wurde [18]. Es konnte gezeigt werden, dass das Modell wesentlich genauer ist als der derzeit empfohlene Diagnosealgorithmus und das Potenzial hat, Überbehandlungen und verzögerte Diagnosen signifikant zu reduzieren. Das Modell wurde als Webanwendung implementiert (https://toradi-hit.org), sollte aber in zukünftigen Studien in einem breiteren Umfeld validiert werden.
Fazit
Die Diagnose der HIT bleibt eine Herausforderung und erfordert sowohl eine genaue klinische Wahrscheinlichkeitsbeurteilung als auch eine schnelle Labordiagnostik. Ein wichtiges klinisches und wissenschaftliches Ziel bleibt die Optimierung des derzeitigen HIT-Diagnosealgorithmus [5]. Verbesserungspotenzial bietet die Integration der automatisierten Berechnung von Scoring-Systemen in die elektronische Patientenakte sowohl für die Prä- als auch für die Post-Test-Wahrscheinlichkeit. Vielversprechend ist auch der Einsatz einer Kombination von schnellen Immunoassays, um die Geschwindigkeit und Genauigkeit der Labordiagnostik zu verbessern [19, 20].
Schließlich besteht ein dringender Bedarf an der Entwicklung neuer hochsensitiver funktioneller Assays, die technisch weniger komplex sind und daher in der Routinepraxis eingesetzt werden können.