Das Geheimnis der Langlebigkeit von Plasmazellen
Die differenzielle Analyse von Plasmazell-Subpopulationen
Antikörper-produzierende Plasmazellen sind zusammen mit den klassischen Gedächtnis-B-Zellen der zentrale Bestandteil der humoralen Immunität. Sie entstehen aus B-Zellen nach Aktivierung durch Antigen und durchlaufen dabei einen fundamentalen zellulären Restrukturierungsprozess, der hauptsächlich durch den Transkriptionsfaktor Blimp1 gesteuert wird. Aus diesem Prozess gehen entweder kurzlebige IgM-produzierende Plasmazellen oder langlebige Plasmazellen hervor, die z. B. IgG produzieren. Langlebige Plasmazellen benötigen zum Überleben den Kontakt zu sogenannten Überlebensnischen, die durch Stromazellen und weitere zelluläre und lösliche Komponenten im Knochenmark ausgebildet werden. Zum Verständnis der Plasmazell-Reifung ist eine genaue Analyse der Differenzierungsschritte von frühen Plasmazell-Vorläufern, den sogenannten Plasmablasten, bis hin zu reifen Plasmazellen unerlässlich. Die Verwendung der Oberflächenmarker CD19, B220, TACI und CD138 in der durchflusszytometrischen Analyse erleichtert nicht nur den Nachweis verschiedener Plasmazelldifferenzierungsstadien, sondern ermöglicht auch die Aufklärung der Mechanismen, die die Langlebigkeit von Plasmazellen kontrollieren.
Schlüsselwörter: Plasmazellen, Plasmablasten, TACI, CD138, Überlebensnische
Antikörper-produzierende Plasmazellen entstehen aus B-Zellen nach Kontakt mit Antigen (Abb. 1A). Antikörper sind Y-förmige Proteine, die aus zwei über Disulfid-Brücken verknüpften identischen schweren (H, heavy) und leichten (L, light) Immunglobulin (Ig)-Ketten bestehen (Abb. 1B). B-Zellen tragen im Gegensatz zu Plasmazellen membranverankerte „Antikörper“, sogenannte B-Zellrezeptoren (BZR). Nach Bindung eines Antigens an seinen spezifischen BZR durchläuft die aktivierte B-Zelle während ihrer Differenzierung in eine Antikörper-sezernierende Plasmazelle eine komplexe Umstrukturierung. Diese führt dazu, dass sich die B-Zelle enorm vergrößert, ihr Endoplasmatisches Retikulum (ER) expandiert und somit zu einer Fabrik für die Produktion und Sekretion von Antikörpern umfunktioniert wird (Abb. 1C). Die Umwandlung einer B-Zelle in eine Plasmazelle wird durch ein komplexes Netzwerk an Transkriptionsfaktoren kontrolliert. Ein Schlüsselfaktor ist hierbei der Transkriptionsfaktor Blimp1 (B lymphocyte-induced maturation protein 1). Blimp1 wird in aktivierten B-Zellen hochreguliert und leitet durch die Repression B-Zell-typischer Faktoren wie Bcl6, Pax5, p53 die Umleitung in den Plasmazellpfad ein (zusammengefasst in [1, 2]). Als Folge der Inhibition von Pax5 kommt es zu einer Herunterregulierung von wichtigen Oberflächenrezeptoren (z. B. CD19, CD20, CD22) und Signalmolekülen, zum Verlust der B-Zell-Identität und zur Manifestierung der Plasmazell-Identität [3].
Je nach Art des Antigens und der Aktivierung können kurzlebige IgM-produzierende Plasmazellen oder langlebige Plasmazellen, die entweder IgG, IgA oder IgE produzieren, gebildet werden. Erhält eine durch Antigen aktivierte B-Zelle die entsprechende T-Zell-Hilfe, beginnt sie zu proliferieren, und die klonal expandierten B-Zellen bilden ein Keimzentrum aus (Abb. 1A). Dort kommt es zur somatischen Hypermutation der Exons, die für die variablen Domänen des Antigen-BZR kodieren, und zum Wechsel der konstanten Region der schweren Kette des BZR (beide Prozesse werden durch das Enzym Activation-induced-cytidine-deaminase, AID vermittelt). Hypermutierte Keimzentrums-B-Zellen mit hochaffinen Antigen-BZR werden selektioniert und können entweder in Gedächtnis-B-Zellen oder frühe, sich teilende Plasmazell-Vorläufer (sogenannte Plasmablasten) differenzieren (Abb. 1A, zusammengefasst in [1, 2, 4]). Wie diese Abzweigung auf molekularer Ebene kontrolliert wird, ist nicht gut untersucht. Die frühen Plasmazellen können dann in Überlebensnischen (z. B. im Knochenmark) einwandern und sich zu langlebigen, nicht proliferierenden Plasmazellen entwickeln [5, 6]. Langlebige Plasmazellen tragen durch die kontinuierliche Produktion protektiver Antikörper zum Schutz gegen erneute Infektion maßgeblich bei und bilden somit einen wichtigen Bestandteil des humoralen Immun-Gedächtnisses. So findet man beim Menschen nach einer Vakzinierung noch jahrelang Antikörper gegen das entsprechende Immunogen im Blut [7].
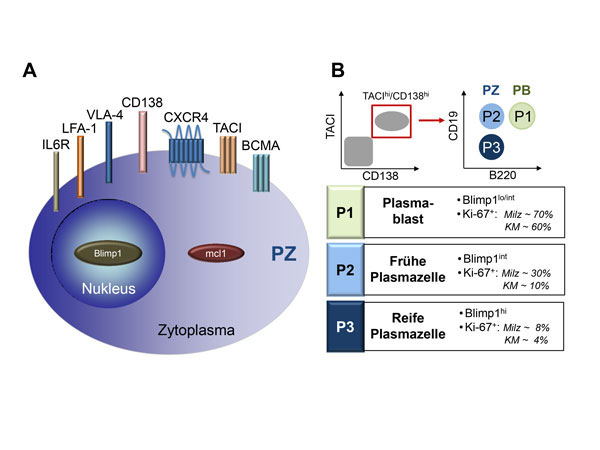
Die Langlebigkeit von Plasmazellen setzt eine Interaktion mit Stromazellen und anderen Zelltypen in sogenannten Überlebensnischen, wie sie z. B. im Knochenmark existieren, voraus [1, 8, 9]. Zur Einwanderung von neu gebildeten Plasmablasten in das Knochenmark ist unter anderem der Chemokin-Rezeptor CXCR4 von entscheidender Bedeutung, dessen Ligand CXCL12 von Stromazellen im Knochenmark produziert wird (zusammengefasst in [1, 2]). Die Komponenten der Nische ermöglichen das Überleben von Plasmazellen einerseits durch Zell-Zell-Kontakte, die über die Expression der Integrine LFA-1 und VLA-4 auf Plasmazellen vermittelt werden [2]. Andererseits werden in der Überlebensnische die Zytokine APRIL und Interleukin-6 (IL6) bereitgestellt, deren Rezeptoren TACI, BCMA (beide binden das Zytokin APRIL) und IL6R auf der Oberfläche der Plasmazelle zu finden sind ([2, 3] und Abb. 2A). Weitere Faktoren, die für die Persistenz von Plasmazellen eine Rolle spielen, sind der Anti-Apoptose-Faktor mcl1 sowie der Transkriptionsfaktor Zbtb20 [10, 11]. Die Signale und die genauen Mechanismen, die zum Erhalt und zum jahrzehntelangen Überleben von Plasmazellen erforderlich sind, sind jedoch weitestgehend ungeklärt. Umso wichtiger ist daher eine detaillierte Anayse der verschiedenen Differenzierungsstadien von Plasmazellen in den verschiedenen Organen.

Die Analyse der Oberflächenmarker CD138 und B220 ist die in der Literatur am häufigsten angewendete Strategie zur durchflusszytometrischen Quantifizierung von Plasmazellen. Die am weitesten differenzierte Plasmazelle trägt noch CD138 auf ihrer Oberfläche, produziert aber im Vergleich zu frühen Plasmazellstadien nur wenig B220 [12]. CD138 (Syndecan-1) ist ein Proteoglykan, welches u. a. auf der Oberfläche von frühen und späten Plasmazell-Stadien exprimiert und an der Bindung von Zytokinen beteiligt ist [13]. B220 ist eine B-Zell-spezifische Variante des CD45 Rezeptors, der eine Rolle bei der B-Zell-Rezeptor (BZR)-vermittelten Signalweiterleitung spielt und in späten Plasmazellen herunterreguliert wird [14]. Diese Methode, basierend auf nur zwei Oberflächenmarkern, erlaubt nur eine Unterscheidung in frühe, B220-positive proliferierende Plasmablasten und späte B220-negative, nicht-proliferierende Plasmazell-Entwicklungsstadien. Unter der Verwendung eines Blimp1:GFP Maus-Reportersystems [15] konnten wir kürzlich zeigen, dass die sogenannte CD138hi/B220lo Plasmazell-Fraktion einen nicht zu unterschätzenden Anteil an Blimp1-negativen Zellen, also Nicht-Plasmazellen, beinhaltet [16]. Daher erscheint diese einfache Färbestrategie zur präzisen Quantifizierung von Plasmablasten und Plasmazellen als ungenügend. Um dieses Problem zu umgehen, entwickelte unsere Arbeitsgruppe ein neues 4-Parameter-Färbe-Protokoll. Dieses beruht auf dem Nachweis der Oberflächenmarker CD138, TACI, B220 und CD19 [16]. TACI ist ein Oberflächenrezeptor aus der Tumor-Nekrose-Faktor-Familie und dient als Rezeptor für die Zytokine BAFF und APRIL [2, 3, 17, 18]. CD19 ist Bestandteil des BZR-Komplexes und moduliert dessen Signale [19, 20]. Unter Verwendung dieser Strategie konnten wir zeigen, dass nicht alle CD138hi/B220lo-Zellen positiv für Blimp1-GFP waren; im Gegensatz dazu produzierten 98% der TACIhi/CD138hi-Population den Blimp1-GFP-Reporter. Deshalb erlaubt das Einbeziehen von TACI zusammen mit CD138 und B220 eine klarere Identifizierung von CD138hi/TACIhi/B220hi -Plasmablasten und späteren CD138hi/TACIhi/B220lo-Plasmazellen. Weiterhin erlaubt uns dieses Protokoll, drei verschiedene Plasmazell-Subpopulationen (P1-P3) zu unterscheiden (siehe Abb. 2B). Die P1-Population (CD138hi/TACIhi/B220int/CD19int) beinhaltet etwa 60–70% proliferierende, Ki67-positive Zellen. Es handelt sich hierbei vorwiegend um Plasmablasten. Die P2-Fraktion (CD138hi/TACIhi/B220lo/CD19int) beinhaltet nur 9–29% Ki67-positive Zellen. Im Gegensatz dazu findet man in der P3-Fraktion (CD138hi/TACIhi/B220lo/CD19lo) die höchste Expression von Blimp1 und kaum proliferierende, Ki67-positive Zellen (Abb. 2B). Bei der P3-Fraktion handelt es sich deshalb um eine nicht-proliferierende, späte Plasmazell-Population, die vor allem im Knochenmark angereichert ist [16]. Neuere Studien unterstützen die Hypothese, dass sich menschliche langlebige Plasmazellen in der CD19-negativen Plasmazellpopulation anreichern [21, 22]. So konnten Landsverk et al. unter Verwendung der C14-Radio-Carbon-Methode zeigen, dass humane langlebige Plasmazellen kein CD19 exprimieren. Ob aber alle CD19-negativen Plasmazellen langlebiger sind als CD19-positive Plasmazellen, ist noch nicht geklärt.
Ausblick
Die Identifizierung eines Oberflächenmarkers zum eindeutigen Nachweis langlebiger Plasmazellen mittels Fluoreszenz-basierter Durchflusszytometrie ist sicher eine der dringenden Aufgaben in der B-Zellbiologie. Eine weitere wichtige Herausforderung ist es, die Dynamik der Generierung von Plasmazellen und ihrer Wanderung zwischen verschiedenen Geweben, wie Milz, Lymphknoten, Darm und Knochenmark zu verstehen. Auch sind die Spieler und vor allem die molekularen Schalter, die die Langlebigkeit einer Plasmazelle kontrollieren, nur unzureichend verstanden. Die vergleichenden Analysen genomweiter Proteom-, miRNom- und Transkriptomstudien verschiedener Plasmazell-Differenzierungsstadien auf Einzelzellbasis (z. B. die hier beschriebenen Fraktionen P1, P2 und P3) könnten neue Ansätze zur Aufklärung der molekularen Mechanismen, die Plasmazellen zum jahrelangen Überleben befähigen, liefern. Langlebige Plasmazellen, die Antikörper gegen körpereigene Strukturen sekretieren (z. B. anti-dsDNA, anti-RNA Antikörper), sind zentrale Effektoren in Autoimmunerkrankungen wie dem systemischen Lupus erythematodes (SLE) oder der Immunthrombozytopenie (ITP) [23, 24]. Die ineffiziente Deletion dieser autoreaktiven Plasmazellen durch therapeutische Antikörper wie Rituximab (anti-CD20) sowie durch Proteasomen-Inhibitoren machen die Entwicklung neuer Strategien zur Depletion von Plasmazellen im Kontext von Autoimmunerkrankungen zwingend erforderlich. Auch wird die detaillierte Charakterisierung der molekularen Mechanismen des Plasmazell-Überlebens maßgeblich zur Entwicklung neuer Therapieansätze beitragen.

