Der immunologische Fingerabdruck
HLA-Differenzierung
Milliarden von Kombinationsmöglichkeiten im HLA-System bestimmen unsere immunologische Identität. Die differenzierte Analyse ist vor allem bei Organtransplantationen und Autoimmunerkrankungen klinisch relevant.
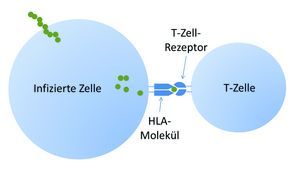
Jeder Mensch exprimiert – wie die meisten Wirbeltiere – auf der Oberfläche sämtlicher kernhaltiger Zellen hochgradig polymorphe Proteine, die für jedes Individuum typisch und in der Kombination nahezu einmalig sind. Die Rede ist vom Haupthistokompatibilitätskomplex (MHC, major histocompatibility complex), der beim Menschen auch HLA-System (human leukocyte antigens) genannt wird. Er ist Teil des Immunsystems und hat die Funktion, den T-Lymphozyten prozessierte Proteinbruchstücke aus dem Zellinneren zu präsentieren, die möglicherweise körperfremd sind (Abbildung 1). Dies können Antigene eingedrungener Viren, mutierte Genprodukte entarteter Krebszellen oder Bestandteile fremder Gewebe sein. Die T-Zellen tasten die MHC-Peptidkomplexe ständig mit spezifischen Rezeptoren ab und lösen im positiven Fall Abwehrreaktionen des Immunsystems aus.
Das HLA-Muster wird von einer Gruppe von MHC-Genen kodiert, die man in die Klassen I und II einteilt. Man könnte es als „immunologischen Fingerabdruck“ bezeichnen, denn mit den heute gängigen Methoden der Typisierung findet man in nur einem von drei bis vier Millionen Fällen eine komplette Übereinstimmung. Je enger der Verwandtschaftsgrad, desto höher ist diese Wahrscheinlichkeit; für Geschwister liegt sie zum Beispiel bei 1:4, und eineiige Zwillinge haben identische Muster.
Auch für die Forensik, zum Beispiel zur Klärung von Paternitätsfragen, ist das HLA-Vererbungsmuster prinzipiell geeignet. Allerdings greift man hier eher auf einfacher zu messende Marker der Individualität, insbesondere short tandem repeats in der DNA-Sequenz zurück.
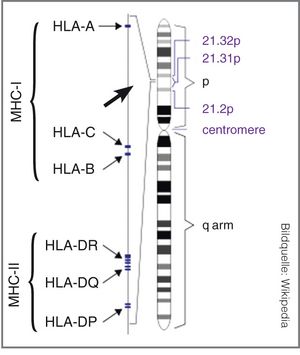
Allein von den MCH-I Gruppen sind Tausende unterschiedlicher Allele beschrieben (Stand Juli 2014: HLA-A 2.884, HLA-B 3.590 und HLA-C 2.375). Bei MHC-II weist HLA-DR mit 1.642 Allelen die meisten Varianten auf. Rein rechnerisch ergeben sich daraus für MHC-I über eine Milliarde, für MHC-II sogar über 40 Milliarden Kombinationsmöglichkeiten. Die tatsächlichen Zahlen liegen niedriger, da die Allele alle im Chromosom 6 gebündelt vorliegen und nicht frei kombinierbar sind (Abbildung 2). Des Weiteren treten bestimmte Kombinationen (Haplotypen) in bestimmten Bevölkerungsgruppen gehäuft auf (linkage disequilibrium).
Dieser gigantische, im Genom einzigartige Polymorphismus stellt sicher, dass von allen potenziell gefährlichen Antigenen immer zumindest einige Peptide erkannt werden, die die Immunabwehr aktivieren. Das gelingt meistens, aber nicht immer perfekt. So werden HIV-Peptide und HIV-infizierte Zellen durchaus erkannt und auch zerstört, aber nicht komplett.
HLA-Typisierung
An erster Stelle der Indikationen für eine HLA-Bestimmung steht die Transplantationsmedizin (Zell-, Gewebe- und Organtransplantation). Für die Stammzell- bzw. Knochenmarksübertragung gibt es gute Daten, dass die Zahl erfolgreicher Transplantationen mit einer hohen Auflösung der HLA-Typisierung gesteigert werden kann. Für solide Organe wird die HLA-Kompatibilität weniger streng gesehen; hier genügt meist eine geringe Auflösung.
Die Bestimmungen sind auch hilfreich, um den Erfolg einer Stammzelltransplantation zu verfolgen, indem die im Blut des Empfängers zirkulierenden Spenderzellen typisiert und quantifiziert werden. Weiterhin wird unter bestimmten Bedingungen für Thrombozytentransfusionen bei Spender und Empfänger das HLA-Muster komplett untersucht, um eine Immunreaktion gegen Spenderthrombozyten möglichst gering zu halten.
Ein noch nicht in allen Details verstandenes Phänomen ist der Mikrochimerismus. Darunter versteht man das Überleben körperfremder Zellen, die die Immunabwehr unterlaufen. So scheint ein Austausch von Zellen zwischen Mutter und Kind durchaus häufig zu sein und möglicherweise als Ursache von Auto-
immunerkrankungen pathophysiologische Bedeutung zu haben. Auch bei Organtransplantationen können Blutzellen des Spenders in den Empfänger gelangen und dort überleben. Ob sie die Tolerierung des Fremdorgans begünstigen, ist derzeit Gegenstand der Forschung.
Autoimmunerkrankungen
Interessanterweise sind manche HLA-Muster auch mit Autoimmunerkrankungen assoziiert. So kommt die Spondylitis ankylosans (M. Bechterew) praktisch nur bei HLA-B27-positiven Individuen vor, die Zöliakie nur bei Patienten mit HLA-DQ2 und/oder -DQ8. Hier wird vermutet, dass die Ähnlichkeit in der Peptidsequenz von Erregern und körpereigenem Material zu Kreuzreaktivitäten führt und so die Erkennung von „Selbst“ und „Nichtselbst“ durcheinander bringt. Im Rahmen der Autoimmundiagnostik genügt es in der Regel, nur die mit der Krankheit assoziierten HLA-Muster zu untersuchen. So wird zum Beispiel in einer 2012 veröffentlichten Leitlinie zur Diagnostik der Zöliakie bei Kindern unter bestimmten Voraussetzungen die Bestimmung von HLA-DQ2/8 gefordert. Liegt keines der beiden Merkmale vor, so kann man eine Zöliakie praktisch ausschließen. Bei symptomatischen Patienten mit negativem Befund muss man nach anderen Erkrankungen fahnden.
Beim M. Bechterew kann eine differenzierte Aufschlüsselung von HLA-B*27 diagnostisch wegweisend sein, da einige Allele (02, 04, 05) eine höhere Krankheitsassoziation aufweisen als andere. Ein umfassendes genomisches Screening bei Erkrankungen mit schwachen Assoziationen zu bestimmten HLA-Typen ist von eher wissenschaftlichem Interesse und hat keine klinischen Konsequenzen.
Companion Diagnostics
Bei der HIV-Therapie schließlich ist im Rahmen der Companion Diagnostics vor einer Behandlung mit Abacavir ein genetischer Test auf das Vorhandensein des HLA-B*57:01-Allels vorgeschrieben, da 50 Prozent der positiven Patienten unter dieser Therapie eine Hypersensitivitätsreaktion (HSR) mit teilweise lebensbedrohlichen Nebenwirkungen erleiden. Das Medikament darf deshalb nur bei negativem Befund verabreicht werden.

Prof. Dr. med. Rudolf Gruber
Mitglied der Redaktion