
Rezidivtherapie des Multiplen Myeloms

Durch die Zulassung zahlreicher neuer Medikamente, insbesondere aus der Gruppe der Immunmodulatoren und Proteasominhibitoren sowie der monoklonalen Antikörper, ist die Behandlung des rezidivierten Multiplen Myeloms in den letzten Jahren erfolgreicher, jedoch zugleich zunehmend komplexer geworden (siehe Abb. 1). Das erweiterte Arsenal an gegen das Multiple Myelom einsetzbaren Substanzen erlaubt heutzutage eine Anpassung der Therapie an Tumor-spezifische Faktoren (z. B. Tumormasse, Proliferationsrate, zytogenetische Hochrisiko-Mutationen), Patienten-spezifische Faktoren (z. B. Alter und Performancestatus, Organfunktionen) sowie den bisherigen Behandlungsverlauf (erhaltene Therapien und Therapieansprechen). Eine autologe Blutstammzelltransplantation vermag bei rezidivierten Myelom-Patienten mit adäquatem Ansprechen auf eine Erstlinien-Transplantation auch in der Rezidivsituation langanhaltende Remission zu erzielen und ist unter den modernen supportiven Maßnahmen bei einer Vielzahl von Patienten durchführbar. Des Weiteren gewinnt das Feld der Immuntherapie rapide an Bedeutung mit der kürzlichen Zulassung der ersten zwei monoklonalen Antikörper im Bereich der Myelomtherapie. Insbesondere die beeindruckenden Ergebnisse, welche mit Anti-CD38-Antikörpern auch in der refraktären Situation erzielt werden können – bei gleichzeitig guter Verträglichkeit –, versprechen die Myelomtherapie in Zukunft grundlegend zu beeinflussen.
Behandlungsoptionen
Eine Vielzahl an Optionen steht mittlerweile für die Behandlung des rezidivierten Multiplen Myeloms zur Verfügung. Im Folgenden wird auf die einzelnen Präparate der verschiedenen Substanzklassen sowie auf die Rolle der autologen und allogenen Blutstammzelltransplantation in der Rezidivsituation detaillierter eingegangen. Eine Übersicht über relevante Therapieschemata, welche neue Substanzen enthalten, inklusive empfohlener Prophylaxen und Zulassungsstatus, gibt Tab. 1.

Immunmodulatoren
Nach Thalidomid stehen mittlerweile mit Lenalidomid und Pomalidomid zwei Immunmodulatoren der nächsten Generation für die Behandlung des rezidivierten Multiplen Myeloms zur Verfügung, welche sich sowohl durch höhere Ansprechraten als auch durch ein verbessertes Nebenwirkungsprofil auszeichnen. Auf Basis zweier großer, multizentrischer, doppelblinder, plazebokontrollierter Phase-III-Studien, der MM-009- und MM-010-Studie, welche die Kombination aus Lenalidomid und Dexamethason (RD) mit alleinigem hochdosiertem Dexamethason bei Myelom-Patienten mit mindestens einer Vortherapie verglichen, erfolgte die Zulassung für RD zur Therapie des Multiplen Myeloms ab dem ersten Rezidiv. In der zusammenfassenden Analyse beider Studien konnte eine signifikante Verbesserung der Ansprechrate (mindestens partielle Remission) im Lenalidomid-Arm (61% versus 22%) sowie des medianen Gesamtüberlebens (38 versus 32 Monate) gezeigt werden [1–3]. Die wichtigsten Grad-3/4-Toxizitäten unter der Therapie mit RD in beiden Studien waren eine Neutropenie (MM-009: 41%, MM-010: 30%) und thromboembolische Ereignisse (MM-009: 15%, MM-010: 11%) [1, 2]. Aus diesem Grund wird die Durchführung einer thromboembolischen Prophylaxe, risikoadaptiert mit niedermolekularen Heparinen oder Azetylsalizylsäure, begleitend zu einer Lenalidomid-haltigen Kombinationstherapie empfohlen. Zudem kann die Nebenwirkungsrate unter RD durch eine Reduktion der Dexamethason-Dosis auf 40mg per os einmal wöchentlich deutlich reduziert werden [4].
Pomalidomid, ein Drittgenerations-Immunmodulator, ist in Kombination mit Dexamethason zur Therapie des Multiplen Myeloms ab dem zweiten Rezidiv zugelassen. In der MM-003-Studie, einer multizentrischen, randomisierten Phase-III-Studie, wurde die Wirksamkeit und Verträglichkeit von Pomalidomid in Kombination mit niedrig-dosiertem Dexamethason im Vergleich zu alleinigem, hochdosiertem Dexamethason bei Patienten mit rezidiviertem und refraktärem Multiplem Myelom evaluiert. Es zeigte sich eine signifikante Überlegenheit des Pomalidomid-Arms sowohl hinsichtlich der Ansprechrate (31% versus 10%) als auch des medianen Gesamtüberlebens (13 versus 8 Monate; [5]). Bemerkenswert ist, dass Pomalidomid bei etwa einem Drittel der Lenalidomid-refraktären Patienten in der Lage war, die Lenalidomid- oder Thalidomid-Resistenz zu überwinden [5]. Zudem scheinen Patienten mit Deletion 17p (del(17p)) im Gegensatz zu Patienten mit Translokation t(4;14) besonders von einer Therapie mit Pomalidomid zu profitieren [6]. Auch für die Behandlung mit Pomalidomid wird die Durchführung einer thromboembolischen Prophylaxe empfohlen.
Proteasominhibitoren
Der reversible Proteasominhibitor Bortezomib stellt aktuell ein Standard-Rückgrat der Rezidivtherapie des Multiplen Myeloms dar. Mittlerweile wurde zudem der irreversible Proteasominhibitor Carfilzomib in der Zweitlinientherapie zugelassen, in den USA besteht des Weiteren bereits eine Zulassung für den oralen Proteasominhibitor Ixazomib. Die Überlegenheit von Bortezomib gegenüber hochdosiertem Dexamethason hinsichtlich Ansprechen und Überleben bei Patienten mit rezidiviertem Multiplen Myelom konnte in der APEX-Studie, einer multizentrischen, randomisierten Phase-III-Studie, gezeigt werden [7]. Zu den häufigsten unter einer Bortezomib-Behandlung auftretenden Nebenwirkungen gehören Fatigue, gastrointestinale Beschwerden, Thrombozytopenie und periphere Polyneuropathie [7]. Bei der Mehrzahl der Patienten zeigen sich die polyneuropathischen Beschwerden im Verlauf als zumindest teilweise reversibel, zudem lässt sich ihr Auftreten und Ausmaß durch eine subkutane anstelle einer intravenösen Applikation ohne gleichzeitige Einschränkung der Effektivität deutlich reduzieren (Polyneuropathie ≥ Grad 2: 24% versus 41%; [8]).
Interessanterweise scheint Bortezomib in der Lage zu sein, den negativen prognostischen Einfluss der zytogenetischen Hochrisiko-Aberrationen t(4;14) und del(17p) zu reduzieren [9]; auch bei Patienten mit Niereninsuffizienz scheint Bortezomib besonders günstig zu sein [10]. Typischerweise wird Bortezomib mit Dexamethason kombiniert (VD), die zusätzliche Kombination mit Cyclophosphamid, pegyliertem liposomalem Doxorubicin, Bendamustin oder einem Immunmodulator kann das Therapieansprechen weiter verbessern.
Der Zweitgenerations-Proteasominhibitor Carfilzomib ist aktuell in Kombination mit Dexamethason (KD) oder Dexamethason und Lenalidomid (KRD) zur Behandlung des Multiplen Myeloms ab dem ersten Rezidiv zugelassen. Carfilzomib zeichnet sich im Vergleich zu Bortezomib durch verbessertes Ansprechen, Wirksamkeit auch bei Bortezomib-refraktären Patienten sowie eine deutlich geringere Rate an Polyneuropathien aus [11]. Die multizentrische, randomisierte Phase-III-Studie ENDEAVOR konnte im Vergleich von KD versus VD bei Patienten mit rezidiviertem und refraktärem Multiplem Myelom eine deutliche Überlegenheit des Carfilzomib-Armes sowohl hinsichtlich des Gesamtansprechens (77% versus 63%) als auch des medianen progressionsfreien Überlebens zeigen (19 versus 9 Monate; [11]). Häufige relevante Nebenwirkungen waren Anämie, Thrombopenie, Bluthochdruck und Pneumonie, zudem wurde bei einer geringeren Anzahl von Patienten von kardialen Komplikationen unter Carfilzomib-Therapie berichtet, was ein gewisses Augenmerk auf in dieser Hinsicht vorgeschädigte Patienten nahelegt [11].
Kombinationstherapie aus Immunmodulator und Proteasominhibitor
Verschiedene Studien zeigen eine Überlegenheit einer Kombinationstherapie aus Immunmodulator und Proteasominhibitor gegenüber der Wirksamkeit der jeweiligen Einzelsubstanzen:
Die Dreierkombination aus Bortezomib, Thalidomid und Dexamethason (VTD) konnte im Vergleich zur Zweier-Kombination aus Thalidomid und Dexamethason (TD) bei Patienten mit rezidiviertem Multiplem Myelom bessere Ansprechraten (87% versus 72%) bei längerem medianem progressionsfreiem Überleben (18 versus 14 Monate) erzielen [12]. Zu beachten ist hier jedoch die signifikant höhere Rate an schweren Polyneuropathien und Thrombopenien unter der Dreifachkombination [12].
Auch die Kombination aus Bortezomib, Lenalidomid und Dexamethason (VRD) konnte in der Rezidivsituation eine überzeugende Wirksamkeit nachweisen, mit einem medianen Gesamtüberleben von 30 Monaten; hinsichtlich der Nebenwirkungen stand hier insbesondere eine erhöhte Hämatotoxizität im Vordergrund [13].
Die multizentrische Phase-III-Studie ASPIRE randomisierte Patienten mit rezidiviertem Multiplem Myelom zu einer Behandlung mit entweder Carfilzomib, Lenalidomid und Dexamethason (KRD) oder Lenalidomid und Dexamethason (RD). Es zeigte sich für die Dreifach-Kombination eine signifikante Verbesserung von Ansprechrate (87% versus 67%) und medianem progressionsfreiem Überleben (26 versus 18 Monate; [14]). Nebenwirkungen vom Grad ≥ 3 im KRD-Arm waren insbesondere Hämatotoxizität, Hypokaliämie und Fatigue; wie auch von der Therapie mit KD bekannt, fand sich unter KRD ein geringer Anteil von Patienten mit neu-aufgetretener Herzinsuffizienz [14].
Ebenfalls vielversprechende Daten hinsichtlich Wirksamkeit und Verträglichkeit wurden für die Immunmodulator-Proteasominhibitor-Kombinationen Carfilzomib, Pomalidomid und Dexamethason sowie für Ixazomib, Lenalidomid und Dexamethason präsentiert, wobei hierfür in Europa aktuell noch keine Zulassung besteht.
HDAC-Inhibitoren
Panobinostat ist ein oraler Histondeacyetylase(HDAC)-Inhibitor, der kürzlich in Europa die Zulassung zur Behandlung des Multiplen Myeloms ab dem zweiten Rezidiv in Kombination mit Bortezomib und Dexamethason erhalten hat. In der PANORAMA-1-Studie, einer multizentrischen, randomisierten, plazebokontrollierten Phase-III-Studie, konnte eine Überlegenheit der Behandlung mit Panobinostat, Bortezomib und Dexamethason (FVD) gegenüber VD hinsichtlich des medianen progressionsfreien Überlebens (12 versus 8 Monate) bei Patienten mit rezidiviertem und refraktärem Multiplem Myelom gezeigt werden [15]. Insbesondere fand sich in der Subgruppe der Patienten mit mindestens zwei vorausgegangenen Therapien, darunter Bortezomib und ein Immunmodulator, eine signifikante Verlängerung des medianen progressionsfreien Überlebens unter der Kombinationsbehandlung mit Panobinostat (13 versus 5 Monate; [16]). Während die Gesamtansprechrate zwischen beiden Studienarmen nicht signifikant unterschiedlich war, fand sich im experimentellen Arm eine signifikant höhere Rate an kompletten oder nahezu kompletten Remissionen (28% versus 16%; [15]).
Relevante Nebenwirkungen unter Behandlung mit Panobinostat waren insbesondere Thrombopenie, Diarrhö und Fatigue [15]. Bemerkenswerterweise kann Panobinostat auch bei einem Teil der Patienten mit voriger Bortezomib-Refraktärität ein Ansprechen erzielen mit einer Gesamtansprechrate in dieser Patientenpopulation von 35% [16].
Monoklonale Antikörper
Zwei monoklonale Antikörper, der Anti-SLAMF7-Antikörper Elotuzumab sowie der Anti-CD38-Antikörper Daratumumab, wurden kürzlich zur Behandlung des rezidivierten Multiplen Myeloms zugelassen. Zahlreiche weitere immunaktive Substanzen sind aktuell in klinischer Entwicklung und versprechen die Myelomtherapie nachhaltig zu verändern. Während Elotuzumab als Monosubstanz nicht effektiv ist und erst in der Kombinationstherapie seine Wirkung entfaltet, kann Daratumumab sowohl als Monotherapie als auch in der Kombination beeindruckendes Ansprechen erzielen, auch wenn für die letztgenannte Konstellation in Europa aktuell noch keine Zulassung besteht.
In der multizentrischen, randomisierten Phase-III-Studie ELOQUENT-2 erhielten Patienten mit rezidiviertem oder refraktärem Multiplem Myelom eine Therapie mit Lenalidomid und Dexamethason (RD) oder RD plus Elotuzumab. Es zeigte sich im Elotuzumab-Arm sowohl eine erhöhte Ansprechrate (79% versus 66%) als auch ein verlängertes medianes progressionsfreies Überleben (19 versus 15 Monate; [17]). Im weiteren Follow-up stellte sich zudem unter Elotuzumab eine deutliche Verlängerung der medianen Zeit bis zur nächsten Therapie dar (33 versus 21 Monate). Infusionsreaktionen traten bei 10% der Patienten im Elotuzumab-Arm auf und waren mehrheitlich vom Grad 1–2 [17]. In der Folge dieser Studie wurde in Europa die Zulassung für Elotuzumab in Kombination mit RD für Patienten mit Multiplem Myelom ab dem ersten Rezidiv erteilt.
Daratumumab konnte als Monotherapie bei schwer vorbehandelten, mehrheitlich Bortezomib- und Lenalidomid-refraktären Patienten eine Ansprechrate von 36% bei einem medianen progressionsfreien Überleben von sechs Monaten erzielen [18]. Infusionsreaktionen traten mit ca. 71% der Patienten deutlich häufiger als unter Elotuzumab auf, waren jedoch überwiegend vom Grad 1–2 und weitgehend auf die Erstgabe beschränkt [18]. Zum momentanen Zeitpunkt besteht infolgedessen die Zulassung für Daratumumab als Monotherapie für Patienten mit Multiplem Myelom ab dem zweiten Rezidiv. In den aktuell noch aktiven randomisierten Phase-III-Studien CASTOR und POLLUX wird VD bzw. RD jeweils mit und ohne Daratumumab bei Patienten mit rezidiviertem Multiplem Myelom verglichen. In der kürzlich präsentierten Interimsanalyse beider Studien zeigte sich eine Überlegenheit der Daratumumab-Kombinationsarme, sodass eine Zulassung von Daratumumab in der Kombinationstherapie für 2017 erwartet wird.
Vierfachkombinationen aus Proteasominhibitor, Immunmodulator, Dexamethason und monoklonalem Antikörper oder gar mehreren Antikörpern werden aktuell ebenfalls im Rahmen klinischer Studien evaluiert.
Blutstammzelltransplantation
Der Stellenwert der Hochdosistherapie mit Melphalan, gefolgt von autologer Blutstammzelltransplantation (SZT) in der Erstlinientherapie des Multiplen Myeloms ist auch in der Ära der flächendeckenden Verbreitung neuer Substanzen fest etabliert. Durch verbesserte Supportivtherapie und adäquate Patientenselektion ist eine autologe SZT heutzutage bei biologisch fitten Patienten bis zu einem Alter von 70–75 Jahren sicher durchführbar [19]. Die Durchführbarkeit und Effektivität einer autologen SZT in der Rezidivsituation konnte mittlerweile ebenfalls wiederholt gezeigt werden [20].
In einer retrospektiven Auswertung zum Vergleich einer Rezidiv-Transplantation mit einer Nicht-Transplantations-Rezidivtherapie auf der Basis neuer Substanzen zeigte sich eine signifikante Überlegenheit der Transplantations-Strategie sowohl hinsichtlich der Dauer des nachfolgenden Therapie-freien Intervalls als auch hinsichtlich des Gesamtüberlebens [21]. Die multizentrische Phase-III-Studie BSBMT/UKMF-Myeloma-X randomisierte Patienten im ersten Rezidiv nach autologer SZT zu einer Bortezomib-basierten Re-Induktion gefolgt von einer Konsolidierung, bestehend aus entweder hochdosiertem Melphalan und autologer SZT oder wöchentlichen Gaben von oralem Cyclophosphamid. Patienten im Transplantationsarm wiesen hier ein signifikant längeres medianes Überleben auf (67 versus 52 Monate), auch wenn das relativ schwache Konsolidierungsregime im Kontrollarm zu bedenken ist [22]. Ergebnisse der prospektiven GMMG-ReLApsE-Studie zu dieser Fragestellung werden im Jahr 2017 erwartet.
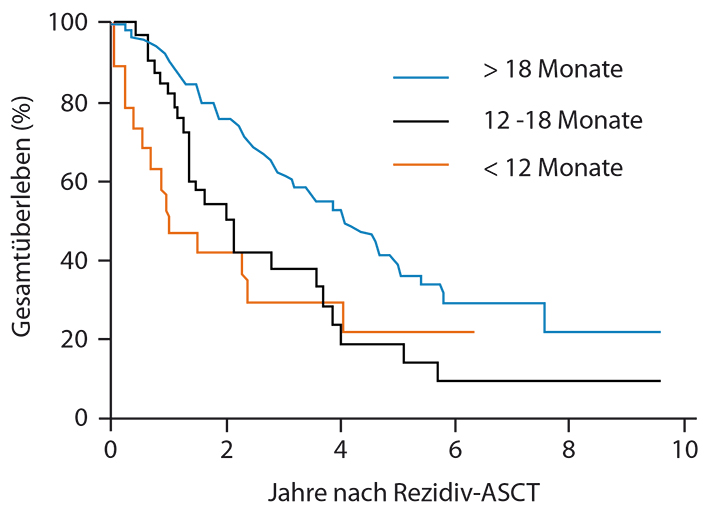
Die Erfolgsaussichten einer autologen SZT in der Rezidivsituation hängen vom Performancestatus des Patienten, der erreichbaren Remissionstiefe durch die Re-Induktion sowie der Remissionsdauer, welche durch eine vorherige SZT erzielt wurde, ab. Zur Einschätzung des Performancestatus gehört die Evaluation des biologischen Alters und die Beurteilung der Organfunktionen sowie möglicherweise persistierender Nebenwirkungen der vorherigen Therapien, z. B. einer Polyneuropathie. Eine adäquate Remissionstiefe ist erfreulicherweise mittels Kombinationstherapien aus neuen Substanzen, z. B. einer Behandlung nach dem KRD-Schema, zumindest in frühen Rezidiven bei der Mehrzahl der Patienten erreichbar. Die erzielte Remissionsdauer nach der vorherigen autologen SZT ist von immenser Bedeutung hinsichtlich der Entscheidung für oder gegen eine Rezidiv-SZT, da in mehreren Studien gezeigt werden konnte, dass Patienten mit einem kurzen progressionsfreien Intervall nach initialer autologer SZT deutlich weniger von einer Rezidiv-SZT profitieren (siehe Abb. 2; [20]). Bei einer Remissionsdauer von weniger als zwölf Monaten nach initialer autologer SZT sollte daher eine Indikation zur Rezidiv-SZT sehr kritisch evaluiert werden.
Ein fester Stellenwert der allogenen SZT beim rezidivierten Multiplen Myelom konnte bisher nicht etabliert werden, da potenzielle Heilungsaussichten für einen geringen Anteil der Patienten weiterhin eine relevante Morbidität und Mortalität durch Graft-versus-Host-Erkrankung gegenüberstehen. Eine multizentrische, retrospektive Analyse von Myelom-Patienten, welche im ersten Rezidiv nach autologer SZT eine HLA-Typisierung unterliefen und in der Folge auf Grundlage der Verfügbarkeit eines passenden Stammzell-Spenders entweder eine alleinige Therapie mit neuen Substanzen oder eine Behandlung mit neuen Substanzen gefolgt von allogener SZT erhielten, konnte zwar ein verlängertes progressionsfreies Überleben in der allogenen SZT-Kohorte zeigen – bei jedoch identischem Gesamtüberleben [23]. Am ehesten scheint eine allogene SZT für Patienten mit Frührezidiv nach initialer autologer SZT eine bedenkenswerte Option darzustellen, jedoch sollte auch hier die allogene SZT in erster Linie im Rahmen von klinischen Studien erwogen werden.
Therapeutische Überlegungen im Rezidiv
Die Vielzahl der möglichen Behandlungsoptionen in der Rezidivtherapie des Multiplen Myeloms erlaubt eine individuelle Therapiegestaltung. Durch sorgfältige Evaluation von Patienten- und Tumor-spezifischen Faktoren, des bisherigen Therapieverlaufes sowie der Patientenpräferenzen können Therapieansprechen und Therapieverträglichkeit optimiert werden. Grundsätzlich ist es erstrebenswert, Patienten soweit wie möglich im Rahmen klinischer Studien zu behandeln.
Bei biologisch jungen Patienten mit adäquatem Ansprechen auf eine initiale autologe SZT (serologische Remissionsdauer > 12 Monate) sollte im Rezidiv nach SZT die Durchführung einer autologen Rezidiv-SZT erwogen werden. Seit der Einführung des CXCR4-Hemmers Plerixafor ist im Falle fehlender Verfügbarkeit eines kryokonservierten Transplantates auch nach bereits zuvor erfolgter Hochdosistherapie eine Stammzellsammlung in vielen Fällen möglich. Bezüglich einer Remissionsinduktion vor Rezidiv-SZT gehören aktuell Proteasominhibitor-Immunmodulator-Kombinationen, z. B. KRD, zu den wirksamsten Therapieregimes und sind insbesondere bei hoher Tumormasse oder -proliferation empfehlenswert. Sollte eine Kombinationstherapie nicht möglich sein, so sollte die Rezidivtherapie zumindest eine neue Substanz enthalten, wobei oftmals ein Wechsel der Substanzklasse im Vergleich zur Initialtherapie, z. B. von Bortezomib-basierter Erstlinientherapie auf eine Lenalidomid-basierte Rezidivtherapie, sinnvoll sein kann.
Bei nicht-transplantablen Patienten ist eine genaue Evaluation von Organfunktionen und Fitness im Alltag essenziell. Hilfreich hierzu kann ein geriatrisches Assessment mittels verschiedener Scores, z. B. dem Katz Activity of Daily Living oder dem Charlson Comorbidity Index, sein [24]. Während eine Proteasominhibitor-Immunmodulator-Kombinationstherapie bei dieser Patientenpopulation meist nicht durchführbar ist, hat sich eine Behandlung mit Lenalidomid und niedrigdosiertem Dexamethason oder mit Bortezomib in wöchentlichen Dosisintervallen und niedrigdosiertem Dexamethason als mehrheitlich gut verträglich erwiesen. Eine Therapie mit Panobinostat unter engmaschiger Kontrolle und ggf. reduzierter Dosis kann ebenfalls bei einigen Patienten praktikabel sein. Die Behandlung mit monoklonalen Antikörpern – im Falle von Elotuzumab zusätzlich zu RD ab dem ersten Rezidiv, im Falle von Daratumumab als Monotherapie ab dem zweiten Rezidiv – ist erfreulicherweise in der Regel auch bei Patienten mit reduziertem Performancestatus gut durchführbar. Der Einsatz eines Antikörpers in der Rezidivsituation kann zunehmend als Standard angesehen werden.
Patienten mit Refraktärität gegenüber Proteasominhibitoren und Immunmodulatoren haben leider auch heutzutage weiterhin eine sehr schlechte Prognose mit einem medianen Überleben von neun Monaten [25], sodass insbesondere bei dieser Patientengruppe neuartige Therapiestrategien im Rahmen klinischer Studien angestrebt werden sollten.
Rasante Fortschritte zeichnen sich insbesondere im Feld der Immuntherapie ab. Mit Elotuzumab und Daratumumab haben zwei monoklonale Antikörper mittlerweile die Zulassung zur Therapie des rezidivierten Multiplen Myeloms erhalten und zeigen auch in der refraktären Situation überzeugende Ergebnisse. Weitere Antikörper gegen verschiedene Zielstrukturen auf Myelomzellen befinden sich in klinischer Entwicklung. Immuncheckpoint-Inhibitoren, z. B. Anti-PD1- und Anti-PDL1-Antikörper, welche in der Therapie verschiedener solider Tumorentitäten bereits fest etabliert sind, werden aktuell auch beim rezidivierten Multiplen Myelom im Rahmen klinischer Studien evaluiert. Erste Ergebnisse zeigen insbesondere in der Kombination mit Immunmodulatoren vielversprechende Wirksamkeit.
Ebenfalls in klinischer Testung befinden sich Antikörper-Toxin-Konjugate sowie CAR-T-Zell-Konstrukte und andere zelluläre Immuntherapie-Ansätze. So steht zu hoffen, dass in Zukunft insbesondere Patienten mit refraktärem Multiplem Myelom verschiedene hochpotente Therapieoptionen angeboten werden können, um so die Prognose dieser Hochrisiko-Population verbessern zu können.
Fazit
Vielseitige Entwicklungen auf dem Gebiet der Myelomtherapie erlauben aktuell eine zunehmend individualisierte Behandlung des rezidivierten Multiplen Myeloms. Eine genaue Evaluation von Patienten- und Tumor-spezifischen Faktoren ist erforderlich, um Wirksamkeit und Verträglichkeit der Therapie zu optimieren.
Immunmodulatoren und Proteasominhibitoren der zweiten und dritten Generation stellen aktuell die Basis der Rezidivtherapie dar. Sehr überzeugende Ergebnisse konnten mit Immunmodulator-Proteasominhibitor-Kombinationstherapien, z. B. Carfilzomib, Lenalidomid und Dexamethason, gezeigt werden.
Die autologe SZT behält auch in der Ära neuer Substanzen ihren Stellenwert in der Rezidivtherapie biologisch junger Patienten, während sich die allogene SZT in der Behandlung des rezidivierten Multiplen Myeloms bisher nicht fest etablieren konnte.
Rasante Fortschritte ereignen sich auf dem Feld der Immuntherapie mit der Zulassung der beiden monoklonalen Antikörper Elotuzumab und Daratumumab zur Rezidivtherapie des Multiplen Myeloms. Weitere Antikörper und Kombinationstherapien aus Proteasominhibitor, Immunmodulator, Dexamethason und monoklonalem Antikörper sowie neuartige Verfahren zur zellulären Immuntherapie sind in klinischer Erprobung.
Literatur
1. Weber DM et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med 2007; 357: 2133-42.
2. Dimopoulos M et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med 2007; 357: 2123-32.
3. Dimopoulos MA et al. Long-term follow-up on overall survival from the MM-009 and MM-010 phase III trials of lenalidomide plus dexamethasone in patients with relapsed or refractory multiple myeloma. Leukemia 2009; 23: 2147-52.
4. Rajkumar SV et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma: An open-label randomised controlled trial. Lancet Oncol 2010; 11: 29-37.
5. San Miguel J et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): A randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14: 1055-66.
6. Leleu X et al. Pomalidomide plus low-dose dexamethasone in multiple myeloma with deletion 17p and/or translocation (4;14): IFM 2010-02 trial results. Blood 2015; 125: 1411-7.
7. Richardson PG et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med 2005; 352: 2487-98.
8. Moreau P et al. Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma: A randomised, phase 3, non-inferiority study. Lancet Oncol 2011; 12: 431-40.
9. Neben K et al. Administration of bortezomib before and after autologous stem cell transplantation improves outcome in multiple myeloma patients with deletion 17p. Blood 2012; 119: 940-8.
10. Scheid C et al. Bortezomib before and after autologous stem cell transplantation overcomes the negative prognostic impact of renal impairment in newly diagnosed multiple myeloma: A subgroup analysis from the HOVON-65/GMMG-HD4 trial. Haematologica 2014; 99: 148-54.
11. Dimopoulos MA et al. Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR): A randomised, phase 3, open-label, multicentre study. Lancet Oncol 2016; 17: 27-38.
12. Garderet L et al. Superiority of the triple combination of bortezomib-thalidomide-dexamethasone over the dual combination of thalidomide-dexamethasone in patients with multiple myeloma progressing or relapsing after autologous transplantation: The MMVAR/IFM 2005-04 randomized phase III trial from the Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2012; 30: 2475-82.
13. Richardson PG et al. A phase 2 trial of lenalidomide, bortezomib, and dexamethasone in patients with relapsed and relapsed/refractory myeloma. Blood 2014; 123: 1461-9.
14. Stewart AK et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015; 372: 142-52.
15. San-Miguel JF et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma: A multicentre, randomised, double-blind phase 3 trial. Lancet Oncol 2014; 15: 1195-206.
16. Richardson PG et al. PANORAMA 2: Panobinostat in combination with bortezomib and dexamethasone in patients with relapsed and bortezomib-refractory myeloma. Blood 2013; 122: 2331-7.
17. Lonial S et al. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med 2015; 373: 621-31.
18. Lokhorst HM et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 2015; 373: 1207-19.
19. Merz M et al. Autologous stem cell transplantation for elderly patients with newly diagnosed multiple myeloma in the era of novel agents. Ann Oncol 2014; 25: 189-95.
20. Sellner L et al. Autologous retransplantation for patients with recurrent multiple myeloma: A single-center experience with 200 patients. Cancer 2013; 119: 2438-46.
21. Grovdal M et al. Autologous stem cell transplantation versus novel drugs or conventional chemotherapy for patients with relapsed multiple myeloma after previous ASCT. Bone Marrow Transplant 2015; 50: 808-12.
22. Cook G et al. The effect of salvage autologous stem-cell transplantation on overall survival in patients with relapsed multiple myeloma (final results from BSBMT/UKMF Myeloma X Relapse [Intensive]): A randomised, open-label, phase 3 trial. Lancet Haematol 2016; 3: e340-51.
23. Patriarca F et al. Allogeneic stem cell transplantation in multiple myeloma relapsed after autograft: A multicenter retrospective study based on donor availability. Biol Blood Marrow Transplant 2012; 18: 617-26.
24. Palumbo A et al. International Myeloma Working Group consensus statement for the management, treatment, and supportive care of patients with myeloma not eligible for standard autologous stem-cell transplantation. J Clin Oncol 2014; 32: 587-600.
25. Kumar SK et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: A multicenter international myeloma working group study. Leukemia 2012; 26: 149-57.

(korrespondierende Autorin)
Dr. med. Nicola Lehners
Priv.-Doz. Dr. med. Marc-Steffen Raab
Sektion Multiples Myelom
Medizinische Klinik V
Universitätsklinikum Heidelberg
Im Neuenheimer Feld 410, 69120 Heidelberg
+49 6221 56-8030
+49 6221 56-4171


