Ein lohnendes Arbeitsgebiet für die Präanalytik
Verfahren zur Präparation von extrazellulären Vesikeln
Exosomen gelten als Übermittler molekularer Informationen zwischen den Zellen. Ihre Erforschung boomt, doch bislang gibt es kein Goldstandard-Verfahren, mit dem man diese Subfraktion extrazellulärer Vesikel (EV) rein darstellen kann. Deshalb ist die Präanalytik gerade für Labormediziner ein lohnendes Arbeitsgebiet.
Schlüsselwörter: Extrazelluläre Vesikel, Exosomen, Ultrazentrifugation, Size Exclusion, Immunocapture
Extrazelluläre Vesikel sind membranummantelte Partikel, die von praktisch jeder Körperzelle an das umgebende Milieu abgegeben werden. Je nach Entstehungsmechanismus unterscheidet man verschiedene Typen, von denen einige in der Lage sind, molekulare Informationen – beispielsweise in Form von Nukleinsäuren oder Proteinen – zwischen verschiedenen Zellen zu übermitteln.
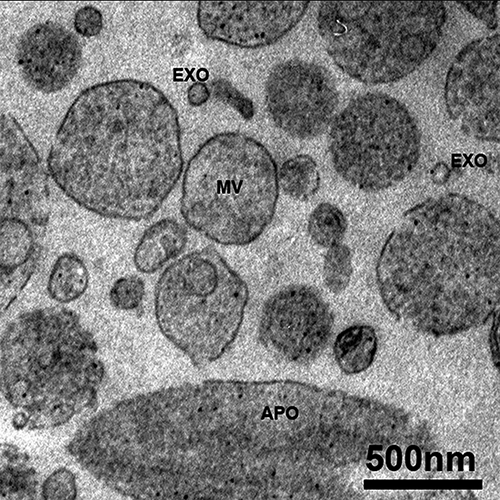
Wenn sie dem Endosomalen System entstammen, bezeichnet man sie als Exosomen. Deren Größe liegt je nach Messmethode sehr reproduzierbar zwischen 70 und 100 nm (elektronenmikroskopische Verfahren) bzw. 110 und 150 nm (Streulicht-basierte Verfahren). Davon zu unterscheiden sind die etwa 100 bis 1.000 nm großen Mikrovesikel, die von der Plasmamembran abknospen, sowie die Apoptotic Bodies mit Größen über 500 nm, die im Rahmen des programmierten Zelltods entstehen.
Heterogene Gemische
Die Größe allein ist allerdings kein gutes Unterscheidungskriterium: Obwohl es in der Fachliteratur kaum diskutiert wird, bilden sich z. B. bei der Apoptose auch kleine Vesikel, die durchaus in der Größenordnung der Exosomen liegen können. Bislang gelingt es auch erfahrenen Wissenschaftlern nicht, die Exosomen als homogene Fraktion molekularer Informationsübermittler zu isolieren. Mit derzeitigen Methoden lassen sich nur mehr oder weniger gut definierte Gemische anreichern. Folglich empfiehlt die International Society of Extracellular Vesicles (ISEV), aufgereinigte Präparationen als „extrazelluläre Vesikelfraktionen" zu bezeichnen. Dieser Empfehlung schließt sich auch die am 2. März 2017 auf dem IGLD-Kongress in Düsseldorf gegründete German Society for Extracellular Vesicles (GSEV) an.
Auftrennung nach der Größe
Klassisch werden extrazelluläre Vesikel durch Zentrifugationsverfahren ankonzentriert. Bei der differenziellen Zentrifugation entfernt man zunächst ganze Zellen bei geringen, danach subzelluläre Verunreinigungen mit etwas höheren G-Zahlen, und schließlich größere Vesikel bei ca. 10.000 x g. Im Überstand verbleiben dann die Vesikel um 100 nm Durchmesser, denen das eigentliche Interesse gilt. Sie lassen sich bei etwa 100.000 x g mittels Ultrazentrifugation sedimentieren.
Auch wenn in dieser Fraktion extrazelluläre Vesikel bereits hoch angereichert sind, finden sich je nach Ausgangsmaterial noch immer zahlreiche Verunreinigungen wie etwa Ribonukleotidpartikel. Wenn eine noch höhere Aufreinigung erforderlich ist, so wird häufig eine Dichtegradientenzentrifugation auf Sucrose-Gradienten, heute zunehmend auch auf Iodixanol-Gradienten angeschlossen. Hiermit lassen sich deutlich höhere Reinheiten für extrazelluläre Vesikel erreichen, doch letztlich sind Verunreinigungen mittels Zentrifugation nie ganz zu beseitigen.
Seit der Jahrtausendwende kommen Sepharosegele mit geeigneten Porengrößen zum Einsatz (Size Exclusion), doch lassen sich auch hiermit keine sauberen extrazellulären Vesikelfraktionen isolieren. Vielversprechend aber sehr zeitaufwendig ist eine Kombination der Dichtegradientenzentrifugation mit diesen Sepharose-Verfahren.
Neuere Verfahren
Als technisch einfachere Variante sind heute Polymere zur Präzipitation von Vesikeln beliebt. In der Regel handelt es sich hierbei um Polyethylenglykole (PEG), die schon in den sechziger Jahren zur Isolation von Bakteriophagen bzw. Viren verwendet wurden. PEG entzieht den Medien Wasser und reduziert das Löslichkeitsprodukt von Molekülkomplexen, sodass diese ausfallen und bei geringen G-Zahlen abzentrifugiert werden können. Auch wenn es die kommerziellen Protokolle nicht vorsehen, empfiehlt es sich für viele nachgeschaltete Analysen, das Polyethylenglykol und andere molekulare Verunreinigungen durch einen Waschschritt mit anschließender Ultrazentrifugation zu reduzieren.
Beim Immunocapture-Verfahren werden Antikörper gegen typische Oberflächenproteine der Vesikel – beispielsweise Tetraspanine – auf Kügelchen aus geeigneten Trägermaterialien aufgetragen. Daran können nun Vesikel gebunden und mit üblichen Laborzentrifugen präzipitiert werden. Immunologische Methoden versprechen eine hohe Reinheit, aber die so gewonnenen EVs lassen sich bislang nicht von den Antikörpern lösen und für funktionelle Analysen nutzen.
Mit steigendem Interesse der Wissenschaft und Industrie werden immer neue Methoden für die Vesikelaufreinigung erprobt und angeboten. Hierzu zählen Filtrations- und Chromatografie-Verfahren, sowie die lange bekannte tangentiale Flussfiltration, die freie Flusselektrophorese (FFE) und verschiedene Arten der Feldflussfraktionierung. Mit Sicherheit wird die Vielfalt der Aufreinigungsmethoden für extrazelluläre Vesikel in Zukunft noch deutlich weiter ansteigen.
Bislang gibt es noch nicht „die" Technik zur Präparation von extrazellulären Vesikeln. Fast alle Methoden weisen Vor- und Nachteile auf, die durch geschickte Kombination partiell ausgeglichen werden können. Mit Verunreinigungen ist aber stets zu rechnen, und deshalb müssen aufwendige Versuche sehr gut konzipiert und kontrolliert werden.
Hier krankt es in vielen Studien, und deshalb wird man – wie in vielen jungen Wissenschaften – einige Ergebnisse, die zunächst als sehr spannend eingestuft wurden, künftig wieder infrage stellen müssen. Mit jeder weiteren Verbesserung der Methodik dürfen wir aber auch mit Entdeckungen rechnen, die neue Wege für die Therapie und Diagnostik aufzeigen.

Priv.-Doz. Dr. rer. nat. Bernd Giebel
Universitätsklinikum Essen
Institut für Transfusionsmedizin
bernd.giebel[at]uk-essen[dot]de
