Therapie des metastasierten kolorektalen Karzinoms – Aktuelle Standards und zukünftige Perspektiven
DOI: https://doi.org/10.47184/tk.2024.05.5Autor: PD Dr. med. Arndt Stahler
Das metastasierte kolorektale Karzinom (mKRK) ist eine heterogene Erkrankung, deren Prognose sich in den vergangenen Jahren kontinuierlich verbessert hat. Dies basiert auf der Verfügbarkeit von effektiven lokalen Therapieoptionen, die bei einer Oligometastasierung angewendet werden, sowie der wachsenden Zahl an zielgerichteten Behandlungsmöglichkeiten, deren Nutzen über die Analyse von Biomarkern prädiziert wird. Dieser Beitrag bietet einen Überblick über aktuelle Standards, aktuelle Studienergebnisse und gegebenenfalls zukünftige Therapien.
Schlüsselwörter: kolorektales Karzinom, Biomarker, lokale Therapie, klinische Studien
Trotz einer fehlenden exakten Definition einer oligometastasierten Erkrankung wird die Evaluation von lokalen Therapiemaßnahmen wie Resektion oder lokal-ablativen Therapien (LAT) empfohlen [1]. Eine R0-/R1-Resektion von Metastasen ist mit einer deutlichen Verbesserung des Gesamtüberlebens (OS) assoziiert [2, 3]. Die Zahl der Metastasen und der betroffenen Organe spielt eine untergeordnete Rolle; auch bei multiplem Organbefall kann also eine Prognoseverbesserung erreicht werden [4]. Bei einer leberlimitierten Erkrankung mit einer Metastasengröße bis ≤ 3 cm ist die LAT einer Resektion bezüglich des OS bei niedrigerer Komplikationsrate nicht unterlegen [5].
Der Stellenwert einer perioperativen Chemotherapie ist aufgrund heterogener Studienpopulationen noch unklar [6, 7]. Bei guter Prognose und technischer Komplexität sollte eine Systemtherapie mit dem Regime FOLFOX (Folinsäure, 5-Fluorouracil und Oxaliplatin) erfolgen. Bei fortgeschrittener Erkrankung mit eingeschränkter Prognose wird eine biomarkerbasierte, bestmögliche Konversionschemotherapie empfohlen [1].
Eine Option für eine selektive Patientenpopulation mit günstiger Tumorbiologie und nichtresektabler, leberlimitierter Erkrankung ist die Durchführung einer Lebertransplantation, die zu einer signifikanten Steigerung des 5-Jahres-OS von 9 auf 73 % geführt hat [8]. Aufgrund der strengen Einschlusskriterien und des generellen Organmangels in Deutschland kann dieses Vorgehen jedoch allenfalls in klinischen Studien diskutiert werden.
Der Nutzen einer additiven Chemotherapie nach erfolgter Lokaltherapie zur Prognoseverbesserung ist hingegen noch offen und wird aktuell nicht von der S3-Leitlinie empfohlen [9]. In der randomisierten Phase-III-Studie PORT (AIO-KRK-0418, FIRE-9) wird diese Fragestellung untersucht. Darin wird eine additive Systemtherapie mit einer aktiven Nachbeobachtung verglichen.
Therapie des irresektablen mKRK: etablierte Biomarker
Bei irresektabler Erkrankung erfolgt die Kombination einer zytostatischen Doublette (CAPOX [Capecitabin plus Oxaliplatin]/FOLFOX oder CAPIRI [Capecitabin plus Irinotecan]/FOLFIRI [Folinsäure, 5-Fluorouracil, Irinotecan]) beziehungsweise in Einzelfällen – bei gutem Allgemeinzustand – einer Triplette aus FOLFOXIRI (FOLFOX plus Irinotecan) in Kombination mit monoklonalen Antikörpern, je nach Tumorkonfiguration. Gemäß (inter-)nationaler Leitlinien sollten der Mikrosatellitenstatus sowie die sporadischen Mutationen der Gene RAS (KRAS/NRAS) und BRAFV600E bestimmt werden [1, 9]. Abb. 1 gibt einen Überblick über gängige Biomarker und deren Prävalenzen.
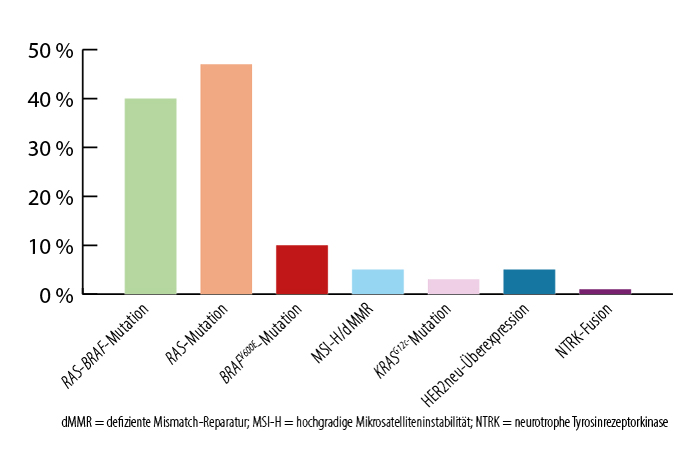
Abb. 1 Biomarkerprävalenzen beim metastasierten kolorektalen Karzinom.
Ungefähr 95 % der mKRK sind mikrosatellitenstabil (MSS). In 5 % der Fälle kann jedoch eine hochgradige Mikrosatelliteninstabilität (MSI-H) beziehungsweise eine defiziente Mismatch-Reparatur (dMMR) diagnostiziert werden, die zur Anhäufung von Genmutationen und damit Neoantigenen führt. Dies klassifiziert für eine Therapie mit Checkpoint-Inhibitoren [10].
Im Gegensatz dazu führt das Vorliegen von Mutationen von RAS (40 % aller Tumoren) oder BRAFV600E (10 % aller Tumoren) zur Überaktivierung des mitogenaktivierten Proteinkinase(MAPK)-Signalwegs. Eine Mutation in diesem Signalweg macht eine alleinige Therapie mit EGFR-Antikörpern (Cetuximab bzw. Panitumumab) wirkungslos [11, 12]. Antikörper gegen den vaskulären endothelialen Wachstumsfaktor (VEGF; Bevacizumab; ab Zweitlinie Ramucirumab oder Aflibercept) hemmen die Tumor-Neoangiogenese und verbessern das progressionsfreie Überleben (PFS) dieser Tumoren [1]. Für die BRAFV600E- und KRASG12C-Mutation (1‑3 % aller Tumoren) existieren mit Encorafenib plus Cetuximab beziehungsweise Sotorasib oder Adagrasib jeweils kombiniert mit Cetuximab beziehungsweise Panitumumab zielgerichtete Therapieoptionen [13‑15].
Für die optimale Therapie sollte weiterhin die Primärtumorlokalisation berücksichtigt werden. Rechtsseitige Tumoren reichen vom Caecum bis (oft vereinfacht genutzt) zur linken Flexur; jenseits der linken Flexur spricht man von linksseitigen Tumoren. In rechtsseitigen Tumoren finden sich häufiger MSI-H sowie BRAFV600E-Mutationen [16].
Therapiealgorithmen ...
... für MSS-Tumoren vom RAS/BRAF-Wildtyp
In der Erstlinientherapie für linksseitige MSS-Tumoren vom RAS/BRAF-Wildtyp wird die Anwendung einer Chemotherapie-Doublette mit EGFR-Antikörpern empfohlen [17]. Die Kombination von FOLFOXIRI mit EGFR-Antikörpern in linksseitigen RAS-Wildtyp-Primärtumoren ist nicht effektiver als eine Doublette [18]. Eine Anti-EGFR-Therapie in rechtsseitigen Primärtumoren führt zu einem besseren Therapieansprechen, jedoch nicht zu einem längeren PFS oder OS [19]. Rechtsseitige RAS-Wildtyp-Tumoren sollten daher mit einem VEGF-Antikörper plus einer Chemotherapie-Doublette oder -Triplette [20] behandelt werden.
In der Zweitlinie wird ein Wechsel des zytostatischen Regimes mit einer gegen VEGF gerichteten Therapie kombiniert [21]. Linksseitige Tumoren ohne Erstlinientherapie mit einem EGFR-Antikörper können diesen in der Zweitlinie erhalten [22].
In der Drittlinie stehen die Optionen Trifluridin/Tipiracil (TAS-102) in Kombination mit Bevacizumab analog der SUNLIGHT-Studie oder eine Rechallenge mit EGFR-Antikörpern nach einem vorherigen Therapieansprechen zur Verfügung [23, 24]. Für die vierte Therapielinie – nach dem Versagen aller anderen Substanzen – ist seit dem Jahr 2024 der VEGF-Tyrosinkinase-Inhibitor Fruquintinib analog den Daten der FRESCO-2-Studie zugelassen. Hierbei kam es zur signifikanten Verbesserung des OS unter Fruquintinib im Vergleich zur alleinigen supportiven Therapie [25].
... für RAS-mutierte MSS-Tumoren
In der Erstlinie werden RAS-mutierte Tumoren ungeachtet der Primärtumorlokalisation mit einer Chemotherapie-Doublette oder -Triplette in Kombination mit einem VEGF-Antikörper behandelt [26]. Die Kombination von Bevacizumab mit FOLFOXIRI im Vergleich zu FOLFIRI verbesserte das PFS und das OS sowie das Therapieansprechen [27]. Die Fortführung von FOLFOXIRI nach der Erhaltungstherapie war effektiver als eine Sequenz von zwei Doubletten (FOLFOX gefolgt von FOLFIRI) [28].
Ab der zweiten Therapielinie kann Bevacizumab unter dem Wechsel der Zytostatika fortgeführt oder – nach vorheriger oxaliplatinbasierter Therapie – FOLFIRI mit Ramucirumab oder Aflibercept kombiniert werden. Die Dritt- und Viertlinie folgen – abgesehen von einer Anti-EGFR-Rechallenge – den Empfehlungen für RAS/BRAF-Wildtyp-Tumoren. Als Off-Label-Option nach der Beantragung einer Kostenübernahme besteht bei KRASG12C-mutierten Tumoren die Möglichkeit zur Kombination von Sotorasib mit Panitumumab. Mit dieser Kombinationstherapie konnte ein beeindruckendes Therapieansprechen von circa 30 % mit einer signifikanten Verlängerung des PFS, nicht jedoch des OS, erreicht werden [14, 29]. Alternative Kombinationen wie Adagrasib und Cetuximab befinden sich in der Evaluation [15].
... für BRAFV600E-mutierte MSS-Tumoren
Aufgrund der ungünstigen Prognose sollten BRAFV600E-mutierte Tumoren in der Erstlinie mit einer Chemotherapie-Doublette oder – bei hohem Remissionsdruck – mit einer Triplette sowie einem VEGF-Antikörper behandelt werden [30].
Zukünftig wird sich mit der Phase-III-Studie BREAKWATER klären, ob die Kombination von Cetuximab mit dem BRAF-Inhibitor Encorafenib mit oder ohne Chemotherapie effektiver ist als eine Chemotherapie allein [31]. Bislang ist die zielgerichtete Therapie Cetuximab/Encorafenib in der Zweitlinie zugelassen [13]. Die Dritt- und Viertlinientherapie entspricht den oben genannten Situationen.
... für MSI-H/dMMR-Tumoren
MSI-H/dMMR-Tumoren zeigen zwar nur ein niedrigeres Ansprechen auf eine zytostatische Therapie, weisen jedoch eine sehr günstige Prognose unter einer Checkpoint-Inhibition auf. Pembrolizumab ist ein monoklonaler PD-1(„programmed cell death protein 1“)-Antikörper und wurde als Erstlinientherapie [32] sowie nach einer Vorbehandlung mit einer fluorpyrimidinhaltigen Therapie für das MSI-H/dMMR mKRK zugelassen [33]. Die Kombination des PD-L1(PD1-Ligand-1)-Antikörpers Nivolumab mit dem CTLA4(„cytotoxic T-lymphocyte-associated protein 4“)-Antikörper Ipilimumab führte zu einem Therapieansprechen von 69 % in der CheckMate-142-Studie. Zudem kam es zu einer konsistenten Verlängerung des PFS und des OS nach vorheriger fluorpyrimidinhaltiger Therapie [34]. In der CheckMate-8HW-Studie geht man in dieser Frage einen Schritt weiter: Untersucht wird die Kombination Nivolumab plus Ipilimumab als Erstlinientherapie in unbehandelten Patienten mit einem MSI-H/dMMR-mKRK gegenüber einer Nivolumab-Monotherapie und einer zytostatischen Therapie. Es hat sich für die Checkpoint-Inhibition im Vergleich zur zytostatischen Therapie ein signifikant längeres PFS und OS ergeben [35]. Noch ausstehend sind die Vergleichsdaten zur Monotherapie mit Nivolumab, die letztlich den Therapiestandard in der Erstlinie entscheidend prägen werden.
Zielgerichtete Therapien gegen HER2/neu und NTRK
Der HER2/neu-Rezeptor zählt zur Familie der EGF-Rezeptoren und ist in circa 5 % aller mKRK entweder überexprimiert oder amplifiziert. Dies kann trotz eines RAS-Wildtyp-Status eine primäre Resistenz gegenüber EGFR-Antikörpern verursachen. Zielgerichtete Therapiemöglichkeiten wie Trastuzumab/Lapatinib (HERACLES-Studie), Trastuzumab/Pertuzumab (MyPathway-Studie), Tucatinib (MOUNTAINEER-Studie) und Trastuzumab-Deruxtecan (DESTINY-CRC01-Studie) haben konsistent in nichtrandomisierten Studien ein vielversprechendes Therapieansprechen, PFS und OS bewiesen [36–38].
Fusionen von NTRK (neurotrophe Tyrosinrezeptorkinase) 1–3 sind mit einer Prävalenz von 1 % noch seltenere Ereignisse und können durch eine Therapie mit Larotrectinib beziehungsweise Entrectinib zielgerichtet adressiert werden [39, 40].
Bislang ist jedoch keine dieser Therapien formal zugelassen, sodass es sich um einen Off-Label-Use handelt, dessen Kostenübernahme bei der zuständigen Krankenkasse beantragt werden muss.
Keine Eignung für intensiven Ansatz: Therapieoptionen
Patienten, die nicht für eine intensive Therapie infrage kommen, können nach aktueller Datenlage entweder mit einer Kombination aus Fluoropyrimidin plus Anti-VEGF-Therapie entsprechend der Daten der AVEX-Studie behandelt werden oder ein dosisreduziertes Kombinationsschema wie beispielsweise mFOLFOX6 80 % analog der FOCUS2-Studie erhalten [41, 42].
Die aktuell rekrutierende, randomisierte Phase-II-Studie FIRE-8 (AIO-KRK/YMO-0519) klärt die Frage nach dem Stellenwert einer Anti-EGFR-Therapie mit Panitumumab gegenüber Bevacizumab in Kombination mit TAS-102 bei Patienten mit RAS-Wildtyp-mKRK, die sich nicht für eine intensive zytostatische Therapie qualifizieren.
Fazit und Ausblick
Die Verfügbarkeit interdisziplinärer Therapiemodalitäten sowie die Weiterentwicklung zielgerichteter Therapieoptionen haben die Prognose und die Therapiestandards des mKRK deutlich verbessert. Eine strukturierte und frühzeitige molekulare Testung der Tumoren wie auch interdisziplinäre Diskussionen in Tumorkonferenzen sind entscheidend, um das Überleben der Patienten zu maximieren. Künftige Studien werden sich neben der Entwicklung weiterer zielgerichteter Optionen vor allem auch mit der Sequenz und Kombination der Therapien beschäftigen.
Autor
PDF-Download
Sie können sich zum Lesen den Artikel auch als PDF herunterladen und anschließend den Fragebogen online ausfüllen.
Sie haben den Artikel gelesen?
Dann füllen Sie jetzt den Fragebogen aus. Sie erhalten 2 CME-Punkte, wenn Sie mindestens 7 von 10 Fragen richtig beantworten.
Jetzt Fragebogen ausfüllen
